下列实验操作完全正确的是
| 编号 |
实验 |
操作 |
| A |
除去粗盐溶液中的Ca2+、SO42- |
依次加入过量的Na2CO3溶 液、BaCl2溶液,过滤后再加适量盐酸 液、BaCl2溶液,过滤后再加适量盐酸 |
| B |
配制480mL0.200mol·L-1 Na2CO3溶液 |
称取28.6 gNa2CO3·10H2O固体,放入到500ml的容量瓶中,加水溶解,振荡摇匀,定容 |
| C |
配制Fe(OH)3胶体 |
将烧杯中的蒸馏水加热至沸腾,向沸水中逐滴加入5~6滴FeCl3饱和溶液。继续煮沸至溶液呈红褐色,停止加热。 |
| D |
取出分液漏斗中所需的上层液体 |
下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 |
下列关于金属的保护的说法中正确的是
| A.以铝为阴极极,可以在铝表面生成一层致密的氧化膜 |
| B.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
| C.生铁(铁碳合金)比纯铁耐酸能力更强 |
| D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是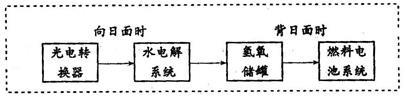
| A.该能量转化系统中的水也是可以循环的 |
| B.燃料电池系统产生的能量实际上来自于水 |
| C.水电解系统中的阳极反应:4OH-―4e-=2H2O+O2↑ |
| D.燃料电池放电时的负极反应:H2-2e-+2OH-=2H2O |
下列说法正确的是
| A.电解饱和食盐水时,阳极的电极反应式为:2Cl- -2e-= Cl2↑ |
| B.氢氧燃料电池的负极反应式:O2 + 2H2O+ 4e- = 4OH- |
| C.粗铜精炼时,与电源正极相连的是纯铜 |
| D.钢铁发生电化腐蚀的正极反应式:Fe-2e- = Fe2+ |
右图装置中发生反应的离子方程式为:Zn+2H+=Zn2++H2↑,下列说法错误的是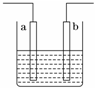
| A.a、b不可能是同种材料的电极 |
| B.该装置可能是电解池,电解质溶液为稀盐酸 |
| C.该装置可能是原电池,电解质溶液为稀盐酸 |
| D.该装置可看作是铜-锌原电池,电解质溶液是稀硫酸 |
下列关于原电池的叙述中,正确的是
| A.原电池中,正极就是阳极,负极就是阴极 |
| B.形成原电池时,在负极上发生氧化反应 |
| C.原电池工作时,溶液中的阳离子向负极移动 |
| D.电流从负极流向正极 |