下列各组离子在指定溶液中,能大量共存的是
| A.加入KSCN显红色的溶液中:Na+、Cu2+、Cl-、I- |
| B.c(CO32-)="0.1" mol/L的溶液中:K+、Na+、SO42-、OH- |
| C.c(H+)/c(OH-)=l012的溶液中:NH4+、Fe2+、NO3-、SO42- |
| D.加入铝粉能产生大量氢气的溶液中:Na+、Ca2+、HCO3-、NO3- |
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g) → CO2(g)+3H2(g)-49.0 kJ
②CH3OH(g)+1/2O2(g)→ CO2(g)+2H2(g)+192.9 kJ
下列说法正确的是
| A.1molCH3OH完全燃烧放出热量192.9 kJ |
B.②中的能量变化如图所示,则Q=E3-E1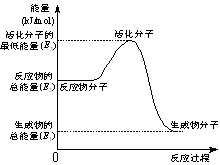 |
| C.H2燃烧能放出大量的热,故CH3OH转变成 H2的过程必须吸收热量 |
| D.根据②推知:在25 ℃,101 kPa时,1 mol |
CH3OH(g)完全燃烧生成CO2和H2O放出的热量应大于192.9 kJ
实验室常用浓H2SO4与硝酸钠反应制HNO3,其方程式为:
NaNO3+H2SO4 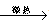 NaHSO4+HNO3↑,制取HNO3时,下图所列装置中最适合的是
NaHSO4+HNO3↑,制取HNO3时,下图所列装置中最适合的是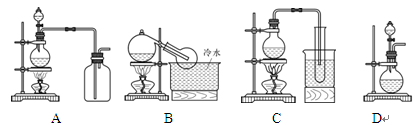
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),
如图所示。导致该现象的主要原因是液滴下面的氧气
含量比液滴边缘少。下列说法正确的是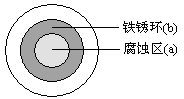
| A.(a)区腐蚀比(b)区腐蚀严重 |
| B.该过程发生了化学反应:4Fe+3O2→2Fe2O3 |
| C.该过程是析氢腐蚀,负极反应为:Fe-2e →Fe2+ |
| D.该过程为吸氧腐蚀,正极反应为:O2+2H2O+4e→4OH- |
室温时,下列各组中的物质分别与足量NaOH溶液反应,生成盐的种类最多的是
| A.Cl2、Al(NO3)3、SO2、SiO2 |
| B.CO2、Al、NaHCO3、N2O5 |
| C.SiO2、NH4HCO3、SO3、CO2 |
| D.CaO、CO2、Cl2、NH4Al(SO4)2 |