西维因是一种高效低毒杀虫剂,在碱性条件下可水解:
有关说法正确的是
| A.西维因分子式为C12H10NO2 |
| B.反应后经酸化,可用FeCL3溶液检验是否发生水解 |
| C.1mol西维因最多能与6mol氢气发生加成反应 |
| D.西维因分子中至少有21个原子共平面 |
下列叙述,正确的是
| A.SiO2制成的玻璃纤维,由于导电能力强而被用于制造光缆 |
| B.用一束光线通过氯化钠溶液和蛋白质溶液,能看到相同的现象 |
| C.SO2和Cl2通入品红溶液,品红均褪色,说明两者的漂白原理相同 |
| D.浓硝酸具有强氯化性,能使铝钝化,故常用铝罐车运输冷的浓硝酸 |
串联电路中四个电解池分别装有0.5 mol·L-1的下列溶液,用惰性电极电解,电解一段时间后,pH最小的是
| A.KNO3溶液 | B.NaCl溶液 | C.AgNO3溶液 | D.CuCl2溶液 |
用氢氧化钠固体配制0.10mol/L的氢氧化钠溶液,下列说法错误的是
| A.定容时俯视,会造成浓度偏高 | B.转移时不慎将转移液溅出,会造成浓度偏低 |
| C.称量时托盘上要垫上干净的称量纸 | D.定容摇匀后发现液面下降,不应继续加水 |
下列实验装置(部分仪器已省略),能达到实验目的的是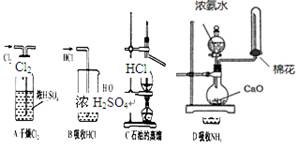
A.干燥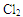 |
B.吸收HCl | C.蒸馏石油 | D.制取氨气 |
化学与生活、社会密切相关。下列说法正确的是
| A.凡含有食品添加剂的食物对人体健康均有害,不可食用 |
| B.为防止电池中的重金属和酸碱等污染土壤和水体,应积极开发废电池的回收利用技术 |
| C.当今社会用量最大的合金是镁铝合金 |
| D.工业上用H2还原MgCl2的方法制取金属镁 |