用NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.在常温常压下,11.2L Cl2含有的分子数为0.5NA |
B.标准状况下,11.2LH2O含有的分子 数为0.5NA 数为0.5NA |
| C.0.5 mol/LFe2(SO4)3 溶液中,SO42-的数目为1.5NA |
| D.2.4g金属镁变为镁离子时失去的电子数为0.2NA |
下列广告语对应商品中含有的物质有误的是
| A.“红梅味精,领先(鲜)一步 ”——蛋白质 |
| B.“衡水老白干,喝出男人味”——乙醇 |
| C.“吃了钙中钙,腰不疼了,腿不痛了,腰杆也直了”——碳酸钙 |
| D.“要想皮肤好,早晚用大宝”——丙三醇 |
X、Y、Z、W有如图所示的转化关系,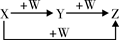 则X、W可能是
则X、W可能是
①C、O2 ②Fe、HNO3 ③S、O2
A.①② B.①③ C.②③ D.①②③
下表为部分短周期元素化合价及其相应原子半径的数据。下列说法正确的是
| 元素性质 |
元素编号 |
|||||||
| A |
B |
C |
D |
E |
F |
G |
H |
|
| 原子半径(nm) |
0.102 |
0.117 |
0.074 |
0.110 |
0.071 |
0.075 |
0.077 |
0.099 |
| 最高化合价 |
+6 |
+4 |
+5 |
+5 |
+4 |
+7 |
||
| 最低化合价 |
-2 |
-4 |
-2 |
-3 |
-1 |
-3 |
-4 |
-1 |
A.C为硫元素
B.A、B是同周期元素
C.F、H的简单离子的电子层结构相同
D.元素G在周期中的位置是第二周期第Ⅳ族
取100mL Fe(NO3)3与Cu(NO3)2的混合液,若这两种溶液物质的量浓度相等。在混合液中加入2.5mol/L NaOH溶液150mL恰好反应,则原溶液中NO3-的浓度为
| A.1.25mol/L | B.3.75mol/L | C.2.5mol/L | D.5.0mol/L |
下列说法正确的是
| A.冰熔化时,分子中H—O键发生断裂 |
| B.NaOH中只含有离子键 |
| C.CO2与SiO2都属于分子晶体 |
| D.熔沸点由高到低的顺序是金刚石>NaCl>I2 |