(1)现有标准状况下的氮气5.6g,其体积为 ,含有氮分子的数目为
(2)标准状况下,2mol NH3与________g CO2的体积相等。
(3)等质量的O2和O3所含的原子个数之比是______________。
(4)实验室使用的浓盐酸的溶质的质量分数一般为36.5%,密度为1.19g/cm-3,
将 升氯化氢(标准状况)通入1.00L水中 可得36.5%的浓盐酸,该浓盐酸的物质的量浓度为 。
可得36.5%的浓盐酸,该浓盐酸的物质的量浓度为 。
(14分)尽管氮元素在地壳中的丰度较低(主要以硝酸盐的形式存在),在所有元素中仅排31位,但是大气中有丰富的氮气,这为氨和硝酸的广泛应用提供了可能。
(1)氮气的电子式为_______,雷电作用能进行氮的固定,写出反应方程式______________。
(2)食物蕴含的营养物质中,含氮的高分子化合物是______________ (填名称),其水解的最终产物为______________。
(3)土壤中的NH4+在硝化细菌的催化作用下可转化为NO3﹣,写出其离子方程式: ______________。
(4)某铜铝合金用足量稀硝酸完全溶解,得到标准状况下NO 11.2 L,再向溶液中加入过量氨水,充分反应后过滤。①滤液显深蓝色是因为含有的离子(填化学式).______________。②若沉淀质量为7.8g,则合金的质量为______________g。
向某密闭容器中加入0.3mol A、0.1mol C和一定量的气体B三种气体,在一定条件下发生反应,各物质浓度随时间变化如下面左图所示。下面右图为t2时刻后改变容器中条件,平衡体系中速率随时间变化的情况且t2—t5四个阶段都各改变一种条件,所用条件均不同。t3—t4阶段为使用催化剂。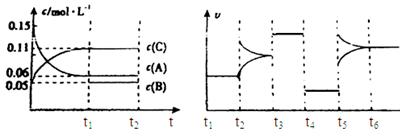
(1)若t1=15s,则t0—t1阶段以C浓度变化表示的反应速率为v(C)=mol/(L∙s);
(2)若t2—t3阶段,C的体积分数变小,此阶段v正v逆(填“大于”、“小于”或“等于”)
(3)B的起始物质的量为mol;
(4)t1时刻,平衡常数K=;
(5)t5—t6阶段容器内A的物质的量共减小0.03mol,而此过程中容器与外界的热交换总量为a KJ,写出该反应的热化学方程式;
(6)若t2时刻后图像变化如下图,则改变条件为
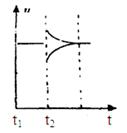
a.恒温恒压下,按照2:1比例充入任意量的B和C
b.恒温恒压下,加入0.24mol A、0.06mol B和0.14mol C
c.恒温恒压下,加入0.12mol A、0.1mol B和0.22mol C
d.恒温恒压下,加入0.14mol B和0.30mol C
醋酸和盐酸是日常生活中极为常见的酸,在一定条件下CH3COOH溶液中存在电离平衡:CH3COOH CH3COO-+H+ ΔH>0
CH3COO-+H+ ΔH>0
(1)常温下,pH=5醋酸溶液中,c(CH3COO-)=______mol/L(精确值,要求列式不必化简);
(2)下列方法中可以使0.10 mol·L-1 CH3COOH的电离程度增大的是
a.加入少量0.10 mol·L-1稀盐酸 b.加热CH3COOH溶液 c.加水稀释至0.010 mol·L-1
d.加入少量冰醋酸 e.加入少量氯化钠固体 f.加入少量0.10 mol·L-1 NaOH溶液
(3)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)_________V(醋酸)(填“大于”、“小于”或“等于”)
(4)用NaOH溶液分别滴定20.00mL0.1mol/L盐酸和20.00mL0.1mol/L醋酸溶液,得到如图所示两条滴定曲线,用NaOH溶液滴定醋酸溶液的曲线是(填“图1”或“图2”)
(5)常温下,将0.1 mol/L盐酸和0.1 mol/L醋酸钠溶液混合,所得溶液为中性,则混合溶液中各离子的浓度按由大到小排序为_______________________________。
(6)下图表示溶液中c(H+)和c(OH-)的关系,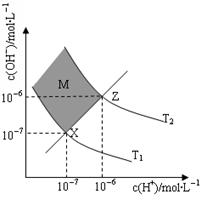
①M区域内(阴影部分)任意点c(H+)______c(OH-)
(填“大于”、“小于”或“等于”)
②在T2温度下,将PH=9 NaOH溶液与PH=4 HCl溶液混合,
若所得混合溶液的 PH=7,则NaOH溶液与HCl溶液
的体积比为。(混合后溶液体积的变化忽略不计)
I.现将反应2Fe3+ + 2I- 2Fe2+ + I2设计成如下图所示的原电池
2Fe2+ + I2设计成如下图所示的原电池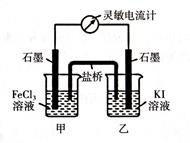
(1)能说明反应达到平衡的标志是__________;(填序号)
a.电流计读数为零 b.电流计指针不再偏转且不为零 c.电流计指针偏转角度最大
(2)若盐桥中装有琼脂-饱和KCl溶液,反应过程中的Cl-移向烧杯________;(填“甲”或“乙”)
(3)反应达到平衡后,向甲中加入适量FeCl2固体,此时___________(填“甲”或“乙”)中石墨电极为负极,对应的电极反应方程式为____________________________。
II.如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。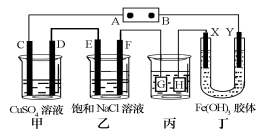
(4)装置乙中电极F的电极反应式____________________;
(5)相同条件下,装置甲、乙的C、E电极生成物质的体积之比为____________________;
(6)欲用装置丙进行粗铜精炼,电极G应该是____________________;
(7)装置丁中电极_______附近红褐色变深,说明氢氧化铁胶粒带正电荷。
有机物A由碳、氢、氧三种元素组成。为研究A的组成与结构,进行了如下实验:
称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。将此9.0gA在足量纯O2中充分燃烧,并使其产物依次通过碱石灰、无水硫酸铜粉末、足量石灰水,发现碱石灰增重14.2g,硫酸铜粉末没有变蓝,石灰水中有10.0g白色沉淀生成;向增重的碱石灰中加入足量盐酸后,产生4.48L无色无味气体(标准状况)。另取A 9.0g,若跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况);若与足量金属钠反应则生成2.24LH2(标准状况)。有机物A可自身发生酯化反应生成六元环的酯B
试通过计算填空:(1)有机物A的相对分子质量为_____________ 。
(2)有机物A的分子式_____________。
(3)A的结构简式 _____________ ,B的结构简式 _____________