关于如图所示装置中的叙述正确的是
| A.电子由Fe流向Pt |
| B.这是电解NaOH溶液的装置 |
| C.Pt为正极,其电极反应为:2H++2e-=H2↑ |
| D.Fe为负饭.其电擞反应为:4OH-4e-=2H2O+O2↑ |
下列操作中,能使电离平衡H2O H++OH-向右移动且溶液呈酸性的是
H++OH-向右移动且溶液呈酸性的是
| A.向水中加入NaHSO4溶液 | B.向水中加入Al2(SO4)3固体 |
| C.向水中加入Na2CO3溶液 | D.将水加热到100℃,使pH=6 |
在0.1mol·L-1的CH3COOH溶液中存在如下电离平衡CH3COOH CH3COO-+H+对于该平衡,下列叙述正确的是
CH3COO-+H+对于该平衡,下列叙述正确的是
| A.加入少量冰醋酸,溶液的pH减小,CH3COOH的电离度增大。 |
| B.滴加少量0.1mol/LHCl溶液,溶液中C(H+)减少。 |
| C.加入少量Na2CO3固体,平衡不移动 |
| D.加水稀释,可使溶液中c(H+)/c(CH3COOH)值增大。 |
下列反应中,属于水解反应且书写正确的是
A.CH3COOH+OH- CH3COO-+H2O CH3COO-+H2O |
B.HCO3—+ H2O CO32- + H3O+ CO32- + H3O+ |
C.NH4+ + H2O  NH3·H2O + H+ NH3·H2O + H+ |
D.S2- + H2O H2S+ OH- H2S+ OH- |
用来表示可逆反应:2A(g)+B(g)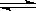 2C(g)(正反应放热)的正确图象是下图中的
2C(g)(正反应放热)的正确图象是下图中的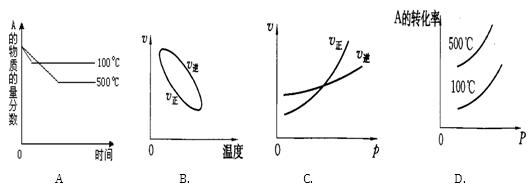
汽车尾气净化中的一个反应如下:NO(g)+CO(g)
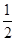 N2(g)+ CO2(g) ΔH=-373.4kJ·mol-1在一容积为5L的恒容密闭容器中充人0.2 mol NO和0.5mol CO,5 min后该反应达到平衡,此时N2的物质的量为0.06mol。下列说法正确的是
N2(g)+ CO2(g) ΔH=-373.4kJ·mol-1在一容积为5L的恒容密闭容器中充人0.2 mol NO和0.5mol CO,5 min后该反应达到平衡,此时N2的物质的量为0.06mol。下列说法正确的是
| A.达到平衡后,若只升高温度,化学平衡正向移动 |
| B.达到平衡后,再通人稀有气体,逆反应速率增大 |
| C.使用催化剂,平衡常数不变 |
| D.0~5 min内,NO的反应速率为2.4×1 0-3 mol·L一1·min一1 |