某化学式趣小组设计了下列四个实验装置,试图在短时间内通过观察实验现象说明CO2与NaOH溶液发生了反应。其中无法达到实验目的的是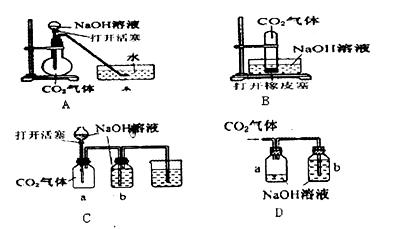
已知4NH3 + 5O2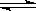 4NO + 6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,正确的关系是
4NO + 6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,正确的关系是
| A.4 v(NH3)=5v(O2) | B.6 v(O2)= 5v(H2O) |
| C.4v(NH3)="6" v(H2O) | D.v(O2)= 4v(NO) |
某反应的△H=+100k J·mol-1,下列有关该反应的叙述正确的是
J·mol-1,下列有关该反应的叙述正确的是
| A.正反应活化能小于100kJ·mol-1 | B.逆反应活化能一定小于100kJ·mol-1 |
| C.逆反应活化能不小于100kJ·mol-1 | D.正反应活化能比逆反应活化能大100kJ·mol-1 |
某合金(仅含铜、铁)中铜和铁的物质的量之和为ymol,其中Cu的物质的量分数为a ,将其全部投入50mL bmol·L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是()
| A.若金属有剩余,在溶液中再滴入硫酸后,金属又开始溶解 |
| B.若金属全部溶解,则溶液中一定含有Fe3+ |
| C.若金属全部溶解,且产生336mL气体(标准状况),则b=0.3 |
D.当溶液中金属离子只有Fe3+、Cu2 +时,则a与b的关系为:b≥80y(1-a/3) +时,则a与b的关系为:b≥80y(1-a/3) |
织物漂白剂亚氯酸钠(NaClO2)在溶液中可生成ClO2,HClO2,ClO2-,Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体。某温度下,各组分含量随pH变化情况如图所示(Cl-没有画出)。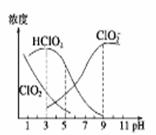
下列说法正确的是 ( )
| A.NaClO2溶液中,c(Na+)/c(ClO2-)=1 |
| B.往NaClO2溶液中滴入稀盐酸,当pH>6时,溶液中主要反应的离子方程式是:ClO2-+H+=HClO2 |
| C.使用该漂白剂的最佳pH为3.0 |
| D.此温度下HClO2的电离平衡常数的数值Ka=10-6 |
室温下,将1.000mol L-1盐酸滴入20.00mL 1.000mol
L-1盐酸滴入20.00mL 1.000mol L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如右图所示。
L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如右图所示。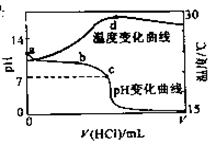
下列有关说法正确的是 ( )
A.a点由水电离出的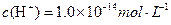 |
B.b点: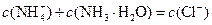 |
C.c点: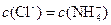 |
D.d点后溶液温度略下降的主要原因是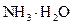 电离吸热 电离吸热 |