下列叙述不正确的是
| A.原子的次外层电子数不一定是8或18个 |
| B.原子最外层电子数都不超过8个 |
| C.一切原子都有质子和电子 |
| D.稀有气体元素的原子最外层电子数一定都是8个 |
室温下,水的电离达到平衡:H2O H+ + OH-。下列叙述正确的是
H+ + OH-。下列叙述正确的是
| A.向水中加入少量盐酸,平衡向逆反应方向移动,c(H+)增大. |
| B.将水加热,平衡向正反应方向移动,Kw不变 |
| C.向水中加入少量NaOH固体,平衡向逆反应方向移动,c(OH-)降低 |
| D.向水中加入少量CH3COONa固体,平衡向正反应方向移动,c(OH-)= c(H+) |
升高温度,下列数据不一定增大的是
| A.化学反应速率v | B.弱电解质的电离平衡常数Ka |
| C.化学平衡常数K | D.水的离子积常数KW |
如图所示,X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味的气体放出,符合这一情况的是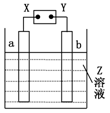
| a极板 |
b极板 |
X电极 |
Z |
|
| A |
铜 |
石墨 |
负极 |
CuCl2 |
| B |
石墨 |
石墨 |
负极 |
NaOH |
| C |
银 |
铁 |
正极 |
AgNO3 |
| D |
锌 |
石墨 |
负极 |
CuSO4 |
在25℃时;用石墨电极电解2.0 L 2.5 mol/L CuSO4溶液(假设溶液的体积在电解前后不发生变化)。5 min后,在一个石墨电极上有6.4 g Cu生成。下列说法中正确的是
| A.有Cu生成的一极是阴极,发生氧化反应 |
| B.反应中转移电子的物质的量为0.4 mol |
| C.在另一极得到O2的体积(标准状况)是1.12 L |
| D.此时溶液的pH为2 |
已知Ksp(AB2)=4.2×10-8,Ksp(AC)=3.0×10-15。在AB2、AC均为饱和的混合液中,测得c(B-)=1.6×10-3 mol·L-1,则溶液中c(C2-)为
A. 7.3×10-13 mol·L-1 B. 1.8×10-13 mol·L-1
C.2.3 mol·L-1 D.3.7 mol·L-1