mA(s)+nB(g)  pC(g);ΔH<0,在室温条件下B的体积分数(B%)与压强(P)的关系如图所示。
pC(g);ΔH<0,在室温条件下B的体积分数(B%)与压强(P)的关系如图所示。
则下列有关叙述中一定正确的是( )
①m+n<p ②X点时的正反应速率大于逆反应速率
③X点比Y点时的反应速率慢④若升高温度,该反应的平衡常数增大
| A.①②③ | B.②③④ | C.只有②③ | D.①②④ |
如图所示装置,将Cl2缓慢通人,若打开旋塞b,则小试管中干燥的
品红试纸c不褪色。再将b关闭,则c不久即褪色。由此判断a溶
液是()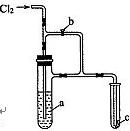
| A.浓KI溶液 | B.浓H2SO4 |
| C.饱和食盐水 | D.NaOH溶液 |
红磷(P)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如下图所示,图中的△H表示生成1 mol产物的数据。已知PCl5分解为PCl3和Cl2是可逆反应。下列说法正确的是()
| A.其他条件不变,升高温度有利于PCl5生成 |
| B.反应2P(s)+5Cl2(g)===2PCl5(g)对应的反应热△H="-798" kJ/mol |
| C.P和Cl2反应生成PCl3的热化学方程式为2P(s)+3Cl2(g)=2PCl3(g)△H="-306" kJ/mol |
| D.其他条件不变,对于PCl5分解生成.PCl3和Cl2的反应,增大压强,PCl5的转化率减小,平衡常数K减小 |
某反应体系的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
下列选项正确的是()
A.框图中的物质分别 为:Na2S4O6、H2O、Na2S2O3、Au2O、NaOH 为:Na2S4O6、H2O、Na2S2O3、Au2O、NaOH |
| B.框图中的物质分别为:Na2S2O3、NaOH、Na2S4O6、Au2O、H2O |
| C.框图中的物质分别为:Na2S2O3、H2O、Na2S4O6、Au2O、NaOH |
| D.当1 mol Au2O3完全反应时,转移电子的物质的量为6 mol |
下列关于铝合金的说法中错误的是()
| A.镁铝合金在冷的浓H2SO4中钝化 |
| B.镁铝合金抗氧化,但能被烧碱腐蚀 |
| C.镁铝合金是一种混合物,它比纯铝的熔点低 |
| D.高温铝液易被氧化,铝合金应在熔剂层覆盖下熔炼 |
为了除去下列括号中的杂质,所用试剂和操作方法都正确的是()
| A.CO2(SO2):饱和Na2CO3溶液,洗气 |
| B.乙酸乙酯(乙酸):乙醇和浓硫酸,加热 |
| C.水(碘):酒精,萃取、分液 |
D.铜粉(铁粉):稀盐酸,过滤、洗涤 、干燥 、干燥 |