室温下取0.2 mol·L-1HCl溶液与0.2 mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
(1)①混合溶液中水电离出的c(H+)__________0.2mol·L-1 HCl溶液中水电离出的c(H+);(填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-)-c(M+)=__________ mol·L-1 c(H+)-c(MOH) =__________ mol·L -1
-1
(2)室温下如果取0.2 mol·L-1 MOH溶液与0.1 mol·L-1 HCl溶液等体积混合,测得混合溶液的pH<7,则说明MOH的电离程度________MCl的水解程度。(填“>”、“<”、或“=”),溶液中各离子浓度由大到小的顺序为_______________________。
(一)对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系。下表为几种弱酸在25℃时的电离平衡常数
| 酸 |
电离平衡常数K |
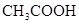 |
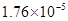 |
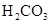 |
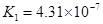 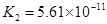 |
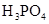 |
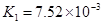 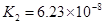 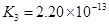 |
回答下列问题:
(1)K只与温度有关,当温度升高时,K值____(填“增大”、“减小”、“不变”)。
(2)从电离的角度,HCO3-、HPO42-、H2PO4-都可看作是酸,其中酸性最强的是_________,最弱的是________。
(3)对于同一种多元弱酸,有不止一个电离平衡常数,多个常数K1、K2、K3、之间存在某种大小关系,此关系是________________;以碳酸为例,用离子方程式和必要的文字说明产生此规律的原因_________________________。
(4)电离平衡常数是用实验的方法测定出来的.现已经测得25℃时,c mol/L的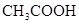 的电离转化率为____,则该温度下醋酸的电离平衡常数
的电离转化率为____,则该温度下醋酸的电离平衡常数 _____。
_____。
(二)化合物SOCl2是一种液态化合物,沸点77 ℃。在盛有10 mL水的锥形瓶中,小心地滴加8~10滴SOCl2,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味的气体逸出。该气体可使滴有品红试液的滤纸褪色。
(1)写出SOCl2和水反应的化学方程式:_____________________________。
(2)把AlCl3溶液蒸干、灼烧,最后得到的主要固体产物是;用SOCl2与AlCl3·6H2O混合共热得到无水AlCl3,原因是________________________ 。
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)  CH3OH(g)下表为不同温度下的平衡常数(K)
CH3OH(g)下表为不同温度下的平衡常数(K)
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
(1)该反应的平衡常数表达式K=,ΔH0(填“>”、“<”或“=”)。
(2)将1 mol的H2和 1 mol 的 CO充入 1 L 恒容密闭反应器中,达到平衡后,容器内的压强为开始时的60%,求CO的平衡转化率(写出计算过程)。
(3)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是
(填字母)。
A.c(H2)减少
B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加
D.重新平衡时c(H2)/ c(CH3OH)减小
(4)其他条件相同时,在上述三个温度下分别发生该反应。300℃时,H2的转化率随时间的变化如图所示,请补充完成350℃时H2的转化率随时间的变化示意图。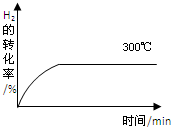
(16分)(一)某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,通过测定褪色所需时间来判断反应的快慢。限选试剂与仪器:0.20mol/LH2C2O4溶液,0.010mol/L 酸性KMnO4溶液,蒸馏水,锥形瓶,恒温水浴槽,量筒,秒表。该小组设计了如下的方案。
| 物理量 |
H2C2O4溶液 |
酸性KMnO4溶液 |
温度/℃ |
|||
| 浓度/mol·L-1 |
体积/mL |
浓度/mol·L-1 |
体积/mL |
|||
| ① |
0 |
0.20 |
2.0 |
0.010 |
4.0 |
50 |
| ② |
0 |
0.20 |
2.0 |
0.010 |
4.0 |
25 |
| ③ |
0.010 |
4.0 |
25 |
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4。为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为:n(H2C2O4):n (KMnO4) ≥_______。
(2)请完成表格内五处空白。
(3)实验③测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=______________mol·L-1·min-1。
(4)已知50℃时c(MnO4—)~反应时间t的变化曲线如下图。其中反应速率最快的阶段是_____,原因是。 
(二)利用下图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的_________(填“深”或“浅”),其原因是_________________________。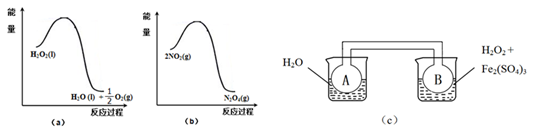
(11分)研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)利用以下反应可处理NO2:6NO2+8NH3 7N2+12H2O ΔH< 0。请在答题卡的坐标图中,画出上述反应在有催化剂和无催化剂两种情况下反应过程中体系能量变化的示意图,并标明反应热。
7N2+12H2O ΔH< 0。请在答题卡的坐标图中,画出上述反应在有催化剂和无催化剂两种情况下反应过程中体系能量变化的示意图,并标明反应热。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH =-196.6 kJ·mol-1
2SO3(g) ΔH =-196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH =-113.0 kJ·mol-1
2NO2(g) ΔH =-113.0 kJ·mol-1
写出1mol SO2与足量NO2反应转变成SO3(g)的热化学方程式。
(3)一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是__________________。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 mol NO2
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=_____(结果取三位有效数字)。
有A、B、C、D、E五种化合物,它们分别由Na+、Ba2+、Cu2+、Al3+、Cl—、SO42—和OH- 等七种离子中的两种组成。①白色固体A既不溶于水,也不溶于稀硝酸。②B与A具有相同的阴离子,在B溶液中加入适量的E溶液时,可生成白色沉淀。③C与E具有相同的阴离子,C与稀硫酸反应可以生成A。④D与A阴阳离子均不相同,D溶液与E溶液反应可以得到蓝色沉淀。根据上述实验事实,回答下列问题:
(1)写出下列物质的化学式:
A___________B___________C___________D___________E___________
(2)写出C与稀硫酸反应的离子方程式: