NaCl是一种化工原料,可以制备一系列物质(见图)。下列说法正确的是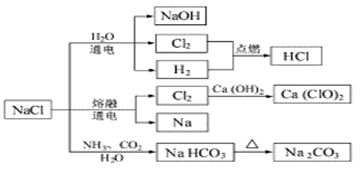
| A.25℃,NaHCO3在水中的溶解度比Na2CO3的大 |
| B.石灰乳与Cl2的反应中,Cl2是氧化剂,Ca(OH)2是还原剂 |
| C.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 |
| D.图中所示转化反应中有4个反应属于氧化还原反应 |
99℃时KW=1x10-12,该温度下在某物质的溶液中,由水电离出的H+浓度为1×10-a mol/L,下列说法不正确的是( )
| A.a<6时,水的电离受到促进 | B.a>6时,水的电离受到抑制 |
| C.a<6时,溶液的pH可能为a | D.a>6时,溶液的pH一定为12-a |
设NA为阿佛加德罗常数,下列叙述中正确的是()
| A.124g白磷中含有P—P键的个数为4NA |
| B.12g石墨中含有C—C键的个数为1.5NA |
| C.1mol金刚石中含有C—C键的个数为2NA |
| D.60gSiO2中含有Si—O键的个数为2NA |
有下列离子晶体空间结构示意图:●为阳离子,○ 为阴离子。以M代表阳离子,N代表阴离子,化学式为MN2的晶体结构为()
为阴离子。以M代表阳离子,N代表阴离子,化学式为MN2的晶体结构为()

下列物质性质的变化规律,与共价键的键能大小无关的是()
①F2、Cl2、Br2、I2的熔点.沸点逐渐升高
②HF、HCl、HBr、HI的热稳定性依次减弱
③金刚石、碳化硅、晶体硅熔点逐渐降低
④NaF、NaCl、NaBr、NaI的熔点依次降低
| A.仅② | B.①④ | C.②③ | D.①②③ |
在盛有足量 A 的体积可变的密闭容器中,加入B ,发生反应: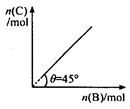
A (s)+2B(g) 4C(g) + D ( g );△H < 0 。
4C(g) + D ( g );△H < 0 。
在t℃.p KPa下达到平衡。平衡时 C 的物质的量与加入的 B
的物质的量的变化关系如右图。下列说法正确的是()
A.平衡 时B的转化率为33.3 % 时B的转化率为33.3 % |
| B.若再加入B,则再次达到平衡时正.逆反应速率均增大,但仍然相等 |
| C.若再加人4molC和1molD ,则再次达到平衡时体系气体密度减小,平均摩尔质量不变 |
| D.若温度变为(t+10)℃,则θ<45° |