合成氨反应为N2+3H2 2NH3,今有A、B、C、D四个容器,每个容器中有两种操作,两种操作分别达到平衡后,操作1中N2和操作2中NH3转化率之和一定不为1的是(起始体积相等)
2NH3,今有A、B、C、D四个容器,每个容器中有两种操作,两种操作分别达到平衡后,操作1中N2和操作2中NH3转化率之和一定不为1的是(起始体积相等)
A. 恒温恒容:操作1:加1 mol N2+3 mol H2,操作2:加2 mol NH3
B. 恒温恒压:操作1:加1 mol N2+3 mol H2,操作2:加2 mol NH3
C. 恒温恒容:操作1:加1 mol N2+3 mol H2, 操作2:加3 mol NH3
D. 恒温恒压:操作1:加1 mol N2+3 mol H2,操作2:加3 mol NH3
结合图判断,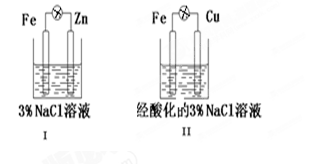
下列叙述正确的是
| A.Ⅰ和Ⅱ中正极均被保护 |
| B.Ⅰ和Ⅱ中Cl-均向Fe电极移动 |
| C.Ⅰ和Ⅱ中负极反应均是Fe-2e-=Fe2+ |
| D.Ⅰ和Ⅱ中正极反应均是O2+4e-+2H2O=4OH- |
某未知溶液中已检验出含有离子Ca2+、NO3-,且pH=2。欲检验此溶液中是否大量存在以下6种离子:①ClO-②NH4+③I-④Fe2+⑤AlO2-⑥Cl-,其中不必检验就能排除的离子是
| A.②③⑤⑥ | B.①③④⑤ |
| C.①④⑤⑥ | D.①②③④ |
氮化铝广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C =2AlN+3CO合成。下列叙述正确的是
| A.上述反应中,N2是还原剂,Al2O3是氧化剂 |
| B.上述反应中,每生成1 mol AlN需转移3 mol电子 |
| C.AlN中氮元素的化合价为+3 |
| D.AlN的摩尔质量为41 g |
设NA为阿伏加德罗常数,下列叙述中,正确的是
| A.标准状况下,NH3和CH4的混合气体2.24L,所含电子总数为2NA |
| B.7g CnH2n中含氢原子数为NA |
| C.78 g 过氧化钠与CO2反应,转移电子数为2NA |
| D.25℃时,0.1mol/L的NaOH溶液中,含有钠离子数为0.1NA |
下列关于能源的说法不正确的是
| A.煤的干馏是物理变化,煤的气化和液化是化学变化 |
| B.煤油可由石油分馏获得,可用作燃料和保存少量金属钠 |
| C.沼气(主要成分是CH4)是可再生能源 |
| D.太阳能、氢能、风能、地热能、生物质能都是新能源 |