下表列出了①~⑥六种元素在周期表中的位置:
| 族 周期 |
ⅠA |
|
0 |
|||||
| 1 |
|
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
|
|
|
① |
② |
|
|
|
| 3 |
③ |
|
④ |
|
|
⑤ |
⑥ |
|
请按要求回答下列问题。
(1)元素①的元素符号是 。
(2)元素②的单质的电子式是 。元素③与元素⑤形成化合物的电子式是 。
(3)元素⑤的原子结构示意图是 。
(4)这六种元素中,位于第三周期且原子半径最小的是(填元素符号) 。
(5)这六种元素的最高价氧化物中,属于两性氧化物的是(填化学式) 。
(6)在盛有水的小烧杯中加入元素③的单质,发生反应的离子方程式为 ;向上述反应后的溶液中再加入元素④的单质,发生反应的化学方程式为 。
感冒是一种常见的病,人患了感冒会咳嗽、流涕、发烧,多喝开水多休息,适当服用一些治疗感冒的药,可以舒缓症状,减轻病情。
(1)药物阿司匹林是一种传统的治疗感冒发烧的老药,从分子结构上看,它可以看作是乙酸酯,其结构简式如下图: 
作为一种解热镇痛药,对于感冒发烧,它有较好的疗效,但大剂量长期空腹服用,容易对胃肠道产生刺激,原因是阿司匹林在胃中会发生酯的水解反应,生成_________和_________(用结构简式表示),阿司匹林分子水解后,能电离出氢离子(H + )的官能团增多,增大了对胃肠道的刺激。
(2)为减小副作用,一般宜饭后服药,并同时服用少量辅助药物,在①硫酸镁、②氢氧化钡、③碳酸钙中选取哪一种?
某同学欲检验抗酸药中是否含有Al(OH) 3 ,操作如下:取药剂3~4片研碎,向样品中加入过量的盐酸,过滤,得澄清溶液,向澄清溶液中滴加NaOH溶液,观察到有白色沉淀,继续加过量NaOH溶液,白色沉淀又溶解。你能得出该抗酸药中__________(填“含”或“不含”)有Al(OH) 3 ,请写出有关反应的化学方程式:
(1)_________________________________________________________________________;
(2)_________________________________________________________________________;
(3)_________________________________________________________________________。
下表是某食品包装袋上的说明:
| 品名 |
浓缩菠萝汁 |
| 配料 |
水、浓缩菠萝汁、蔗糖、柠檬酸、黄原胶、甜蜜素、维生素C、菠萝香精、柠檬黄、日落黄、山梨酸钾等 |
| 果汁含量 |
≥80% |
| 生产日期 |
标于包装袋封口上 |
从表中的配料中分别选出一种物质填在相应的横线上。其中属于着色剂的有__________,属于调味剂的有__________,属于防腐剂的有__________,属于营养强化剂的有__________。
氯普鲁卡因盐酸盐是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下: 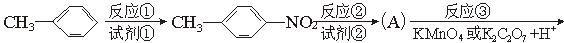
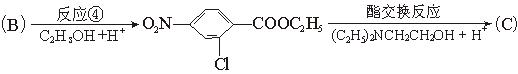
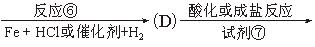
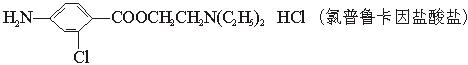
请把相应反应名称填入下表中,供选择的反应名称如下:
氯化、还原、硝化、磺化、氯代、酸化、碱化、成盐、酯化、酯交换、水解
| 反应编号 |
① |
② |
③ |
④ |
⑥ |
| 反应名称 |
大家都知道 6月1日 是国际儿童节,但或许绝大多数人并不了解这天同时也是“世界牛奶日”。20世纪50年代,法国的促进牛奶消费协会提出了庆祝“牛奶日”的设想,并做出了每年5月第三周的周二为“国际牛奶日”的决定,2000年经联合国粮农组织(FAO)的提议,兼顾到某些国家已经确定的日期,并征得了世界700多位乳业界人士的意见,把每年的 6月1日 确定为“世界牛奶日”。人体中的钙元素主要存在于骨骼和牙齿中,以羟基磷酸钙晶体〔Ca 10 (PO 4 ) 6 (OH) 2 〕形式存在。牛奶含钙丰富又易吸收,且牛奶中钙和磷比例合适,是健骨的理想食品。下图是某乳业公司纯牛奶包装标签的部分文字。请仔细阅读后回答下列问题:
| 纯牛奶 配料:鲜牛奶 保质期:8个月 净含量:250 mL/盒 营养成分(每100 mL) 钙≥ 0.11 g 脂肪≥ 3.3 g 蛋白质≥ 2.9 g |
(1)羟基磷酸钙中钙元素的质量分数为__________(保留到 0. 1 g )
(2)包装标签上脂肪≥ 3. 3 g ,是指100 mL牛奶中含脂肪至少 3. 3 g 。那么一盒牛奶中含钙至少__________ g。(保留到 0. 01 g )