对于平衡体系mA(g)+nB(g)  pC(g)+qD(g) ΔH<0,有下列判断,其中正确的是 ( )
pC(g)+qD(g) ΔH<0,有下列判断,其中正确的是 ( ) 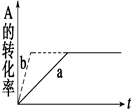
A.若温度不变,将容器的体积扩大1倍,此时A的浓度变为原来的0.6倍,则m+n<p+q
B.若平衡时,A、B的转化率相等,说明反应开始时A、B的物质的量之比为m∶n
C.若平衡体系共有气体a mol,再向其中加入b mol B,当 重新达到平衡时,气体的总物质的量等于(a+b),则m+n>p+q
D.加催化剂或增大压强,可实现右图中a―→b的变化
在一定温度下,容器内某一反应中M、N的物质的量n随反应时间t变化的曲线如图所示,下列表述中正确的是
A.反应的化学方程式为2M N N |
| B.t2时V正=V逆,达到平衡 |
| C.t3时V正> V逆 |
| D.t1时浓度c(N)=2c(M) |
在某温度下,可逆反应mA + nB  pC + qD的平衡常数为K,下列说法正确的是
pC + qD的平衡常数为K,下列说法正确的是
| A.K越大,达到平衡时,反应进行的程度越大 |
| B.K越小,达到平衡时,反应物的转化率越大 |
| C.K随反应物浓度的改变而改变 |
| D.K随温度和压强的改变而改变 |
可逆反应∶2NO2 2NO+O2在密闭容器中反应,达到平衡状态的标志是:
2NO+O2在密闭容器中反应,达到平衡状态的标志是:
①单位时间内生成n molO2的同时生成2n molNO2②单位时间内生成n molO2的同时,生成2n molNO③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态⑥混合气体的平均相对分子质量不再改变的状态
| A.①④⑥ | B.②③⑤ | C.①③④ | D.①②③④⑤⑥ |
高氯酸铵(NH4ClO4)加热至483 K时,可完全分解成N2、Cl2、O2和H2O,则反应中氧化产物与还原产物的物质的量之比是
| A.1∶1 | B.1∶3 | C.2∶1 | D.3∶1 |
若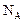 代表阿伏加德罗常数,下列说法正确的是
代表阿伏加德罗常数,下列说法正确的是
A.1 molCl2参加反应转移电子数一定为2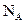 |
B.将31g的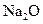 溶解于1L水中,所得溶液中 溶解于1L水中,所得溶液中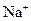 的物质的量浓度为1 mol/L 的物质的量浓度为1 mol/L |
| C.常温常压下,22.4L的NH3和16g CH4中所含有的电子数都是10NA |
D.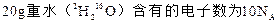 |