MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研 究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2的实验,其流程如下:
究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2的实验,其流程如下:
已知第② 步反应的离子方程式为:5Mn2+ + 2ClO3- + 4H2O → 5MnO2↓ + Cl2↑
步反应的离子方程式为:5Mn2+ + 2ClO3- + 4H2O → 5MnO2↓ + Cl2↑ + 8H+
+ 8H+
根据题意完成第41~46题:
41.第①步加稀H2SO4时,粗MnO2样品中的 (写化学式)转化为可溶性 物质。
物质。
42.写出第③步反应的化学方程式  ;
;
43.实验室里完成第③步蒸发操作必需的仪器有铁架台(含铁圈)、 、 、玻璃棒。
44.该流程中可以循环使用的物质是 。
45.若粗MnO2样品的质量为12.69g,第①步反应后,经过滤得到8.7g MnO2,并收集到0.224 L CO2(标准状况下),则在第①步反应中至少需要 mol H2SO4。
46.已知2H2O2(l) → 2H2O(l) +O2(g),反应过程的能量变化如图所示。
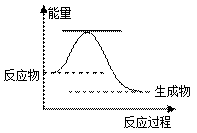 |
①该反应为 反应(填“吸热”或“放热”)。
②请用虚线在图中画出使用MnO2作催化剂的情况下反应过程中体系能量变化示意图。
下列实验操作中错误的是()
| A.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
| B.蒸馏操作时,应向蒸馏液体中加入几块沸石,以防止暴沸 |
| C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D.萃取操作时,可以选用CCl4或酒精作为萃取剂从碘水中萃取碘 |
将标准状况下的 LHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是( )
LHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是( )
下列叙述中,错误的是( )
| A.阿伏加德罗常数的符号为NA,其近似值为6.02×1023 mol-1 |
| B.等物质的量的O2与O3,所含氧原子数相同 |
| C.在0.5 mol Na2SO4中,含有的Na+数约是6.02×1023 |
| D.摩尔是物质的量的单位 |
在标准状况下,若VL甲烷中含有的氢原子个数为n,则阿伏加德罗常数可表示为( )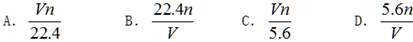
用NA表示阿伏加德罗常数的数值,则下列说法中正确的是 ( )
| A.氮气的摩尔质量等于NA个N2分子的相对分子质量之和 |
| B.1mol氯气的质量等于NA个氯原子的质量 |
| C.NA个氮气分子与NA个一氧化碳分子的质量比不是1:1 |
| D.常温常压下,NA个氢分子的质量为2g |