下列离子方程式正确的是( )
A.NaHSO3溶液中投入过氧化钠粉末:4HSO+ 2Na2O2===4SO+O2↑+4Na+ 2Na2O2===4SO+O2↑+4Na+ |
| B.惰性电极电解氯化钠溶液:2Cl-+2H2OCl2↑+H2↑+2OH- |
| C.氢氧化钙溶液与碳酸氢镁溶液反应:HCO+Ca2++OH-===CaCO3↓+H2O |
| D.向次氯酸钙溶液通入过量CO2:Ca2++2ClO-+CO2+H2O===CaCO3↓+2HClO |
4 mL O2和3 mL NxHy(y>x)的混合气体在120 ℃、1.01×105 Pa条件下充分反应,恢复到原来的温度和压强时,测得混合气体(N2、O2、H2O)的密度比原来减少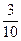 。
。
(1)写出其反应的化学方程式。
(2)推算NxHy的化学式。
取A、B、C三种金属各0.1 mol,分别与足量的盐酸反应,在标准状况下,共生成6.72 L氢气。又知B、C所产生的氢气的体积比是2∶1,且两者产生氢气的体积之和跟A产生的氢气相等。则在氯化物中A元素的化合价为( )
A.+1 B.+2 C.+3 D.+4
用向上排空气法在容积为V mL的集气瓶中收集HCl,收集后瓶内气体的密度是相同条件下He密度的8.75倍。将此集气瓶倒置于水中,瓶内水面上升到一定高度后立即停止上升,则同温同压下,瓶内剩余气体的体积为( )
| A.V/4 mL | B.V/5 mL | C.V/6 mL | D.无法判断 |
把15 g两种金属的混合粉未投入足量盐酸中,待反应完全后,得到11.2 L H2(标准状况下),下列各组中肯定不能组成上述混合物的是( )
| A.Mg和Ag | B.Cu和Zn | C.Mg和Fe | D.Al和Mg |
某物质W在一定条件下加热分解2W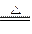 X+2Y+4Z,生成物都是气体,测得由生成物组成的混合气体对H2的相对密度为11.43,则W的相对分子质量是( )
X+2Y+4Z,生成物都是气体,测得由生成物组成的混合气体对H2的相对密度为11.43,则W的相对分子质量是( )
| A.80.01 | B.79 | C.69.82 | D.无法计算 |