(12分)某固体混合物可能含Al、(NH4)2SO4、MgCl2、A1Cl3、FeCl2、NaCl中的一种或几种,现对该混合物作如下实验,所得现象和有关数据如图(气体体积已换算成标况下体积):
回答下列问题: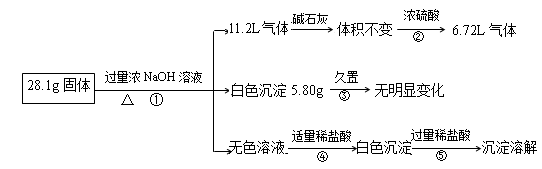
(1)混合物中是否存在FeCl2 ___ (填“是”或“否”);你的判断依据是:
.
(2)混合物中是否存在(NH4)2SO4 ___ (填“是”或“否”),你的判断依据是:
。
(3)写出反应④的离子反应式: 。
(4)请根据计算结果判断混合物中是否含有AlCl3 __ _(填“是”或“否”),你的判断依据是:
。
下表中物质的分类组合完全正确的是( )
| 编号 |
A |
B |
C |
D |
| 强电解质 |
Ba(OH)2 |
盐酸 |
HClO4 |
BaSO4 |
| 弱电解质 |
HI |
CaCO3 |
HClO |
NH3·H2O |
| 非电解质 |
SO2 |
NH3 |
Cl2 |
乙醇 |
下列各组物质中,第一种是酸,第二种是混合物,第三种是碱的是( )
| A.空气、硫酸铜、硫酸 | B.水、空气、纯碱 |
| C.氧化铁、胆矾、熟石灰 | D.硝酸、食盐水、烧碱 |
相同体积的氯化钠、氯化镁、氯化铝溶液分别与过量的硝酸银溶液反应,所生成的沉淀物质的量相同,则原氯化钠、氯化镁、氯化铝溶液的物质的量浓度之比为( )
| A.1 :2 :3 | B.3 :2 :1 | C.6 :3 :1 | D.6 :3 :2 |
下列现象或应用中,不涉及胶体性质的是( )
| A.在饱和氯化铁溶液中逐滴加入NaOH溶液,产生红褐色沉淀 |
| B.清晨,在茂密的树林中,常可以看到从枝叶间透过的光柱 |
| C.用半透膜分离淀粉和食盐的混合液 |
| D.肾功能衰竭等疾病引起的血液中毒,可用血液透析进行治疗 |
医学上由于肾功能衰竭会引起血液中毒,需进行净化排毒,常用的血液净化方法与下列过程相似的是( )
| A.聚沉 | B.电泳 | C.渗析 | D.过滤 |