NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A.常温下,1 L 0.5 mol·L-1 NH4Cl溶液中含有3.01×1023个NH |
| B.1mol甲基(—CH3)所含的电子数为8NA |
| C.7.8g Na2O2与CO2完全反应,转移的电子数为0.1NA |
| D.80mL 10mol/L的浓盐酸与足量MnO2加热反应,转移的电子数为0.4NA |
YBa2Cu8Ox(Y为元素钇)是磁悬浮列车中的重要超导材料,关于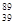 Y的说法不正确的是( )
Y的说法不正确的是( )
| A.钇元素属于金属 | B.质子数与中子数之差为50 |
| C.原子的核外电子数是39 | D.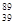 Y和 Y和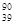 Y是两种不同的核素 Y是两种不同的核素 |
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀生成;
(2)第二份加足量NaOH溶液后,收集到气体0.05mol;
(3)第三份加足量BaCl2溶液后,得干燥沉淀4.3g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。
根据上述实验,以下推测正确的是()
| A.K+一定存在 | B.混合溶液中c(CO32-)为1 mol/L |
| C.Cl-一定存在 | D.Ba2+一定不存在,Mg2+可能存在 |
已知,25℃时有关弱酸的电离平衡常数如下:
则下列有关说法正确的是()
| A.等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) |
| B.a mol·L-1 HCN溶液与b mol·L-1NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则b一定大于a |
| C.向冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离度、pH均先增大后减小 |
| D.等物质的量NaHCO3和Na2CO3的混合溶液中,一定存在: c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
下图甲池和乙池中的四个电极都是惰性材料,乙池溶液分层,上层溶液为盐溶液,呈中性。请根据图示判断下列有关说法不正确的是()
| A.甲池是原电池、乙池是电解池 |
| B.通入乙醇的惰性电极的电极反应式为:C2H5OH+16OH--12e-=2CO32-+11H2O |
| C.反应一段时间后,两池溶液的pH均未变化 |
| D.假如乙池中加入NaI溶液,则在乙池反应过程中,可以观察到C电极周围的溶液呈现棕黄色,反应完毕后,用玻璃棒搅拌溶液,则下层溶液呈现紫红色,上层接近无色 |
用Pt电极电解含有Cu2+和X3+各0.1 mol 的溶液,阴极析出固体物质的质量m g与溶液中通过电子的物质的量n mol的关系如图。则离子的氧化能力由大到小排列正确的是()
| A.Cu2+>X3+>H+ | B.H+>X3+>Cu2+ |
| C.Cu2+>H+>X3+ | D.X3+>H+>Cu2+ |