(共17分)Ⅰ、一无色透明的溶液做如下实验:
ⅰ取少量溶液滴加盐 酸酸化的BaCl2溶液,只观察到有白色沉淀生成。
酸酸化的BaCl2溶液,只观察到有白色沉淀生成。
ⅱ另取部分溶液加入Na2O2,有无色无味气体放出且有白色沉淀生成,加入Na2O2的量与生成 沉淀的量的关系如图所示:
沉淀的量的关系如图所示: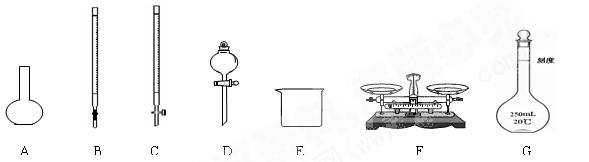 试问:
试问:
(1)Cu2+、NH4+、Al3+、Mg2+、Na+、Fe3+、CO32-、K+、SO42-等离子中一定存在的离子是____、____、______;可能存在的离子是_______、_____;一定不存在的是______、____、_____、____。
(2)上述溶液至少由__________、_________等物质混合成。(填化学式)
Ⅱ、甲烷在高温下与水蒸气反应反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g)。部分物质的燃烧热数据如下表:
| 物 质 |
燃烧热(kJ·mol-1) |
| H2(g) |
-285.8 |
| CO(g) |
-283.0 |
| CH4(g) |
-890.3 |
已知1mol H2O(g)转变为1mol H2O(l)时放出44.0 kJ热量。
⑴写出CO燃烧的热化学方程式 。
⑵ 2H2(g) + O2(g)="=" 2H2O(g) △H= kJ/mol
已知二氧化硅,二氧化硫和二氧化碳都是酸性氧化物,化学性质具有一定的相似性,镁和钠的化学性质也具有一定的相似性。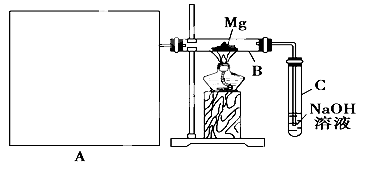
Ⅰ.用如上图所示装置进行镁和二氧化硫的实验,其中A是制备二氧化硫的发生装置。
(1)选择制取二氧化硫的合适试剂 (填序号)。
①10%的硫酸溶液②80%硫酸溶液③亚硫酸钠固体④亚硫酸钙固体
(2)写出装置B中发生反应的化学方程式: 。
装置C中氢氧化钠溶液的作用是 。
(3)请在图中画出制备二氧化硫的发生装置,注明仪器名称,固定仪器省略不画。
(4)你认为该装置的不足之处是 (任写2条)。
Ⅱ.某研究性学习小组进行了“实验室制硅”的研究,查阅资料知:①工业上在高温时用碳还原二氧化硅可制得硅;②镁在点燃的条件下即可与二氧化硅反应;③金属硅化物与稀硫酸反应生成硫酸盐与四氢化硅;④四氢化硅在空气中自燃。
他们在实验报告中记录着:“……选用合适的物质在适宜的条件下充分反应,再用足量稀硫酸溶解固体产物;然后过滤,洗涤,干燥,最后称量……在用稀硫酸溶解固体产物时,发现有爆鸣声和火花,其产率也只有预期值的63%左右。”
(5)该小组“实验室制硅” 的化学方程式是 。
(6)你估计“用稀硫酸溶解固体产物时,发现有爆鸣声和火花:的原因是 。
在化学研究领域,经常需要对一些物质进行性质的确定。如利用下列装置(夹持仪器已略去)测出一定质量镁与盐酸反应放出的气体体积,对金属镁的相对原子质量进行测定,实验步骤如下:
①准确称量m g金属镁(已除去表面氧化膜),用铜网包住放入干净的试管中;
②按图示组装好装置,然后在关闭活塞的分液漏斗中装入一定体积2 mol/L的盐酸;
③调整右边玻璃管(带均匀刻度值),让U型管两端液面在同一水平面,读出右边玻璃管的液面刻度值为V1mL;
④打开分液漏斗活塞,让一定量的盐酸进入试管中后立即关闭活塞;
⑤当镁条反应完后, ,读出右边玻璃管的液面刻度为V2 mL。
请回答下列问题:
(1)写出你认为步骤⑤中空格应进行的操作 。
(2)若V1,V2均是折算为标况下的值,则镁的相对原子质量Ar(Mg)的实验测定表达式为Ar(Mg)= ,你认为此表达式求出的值是否准确? (填‘是’或‘不’),主要问题为 (若回答‘是’则此空不填)。(2+1+1=4分)
(3)步骤①中,为什么要用铜网包住镁条? 。
实验目的:探究过氧化钠与水反应后的溶液滴加酚酞试液先变红后褪色的原因。
[分析与猜想]
(1)根据过氧化钠与水反应的原理:2Na2O2+2H2O=4NaOH+O2↑,往过氧化钠固体完全溶解反应后的溶液中滴加酚酞本应只会变红而不会褪色,而实验中发现酚酞变红后又褪色。由此提出如下的猜想:
A.氧气有漂白性 B.氢氧化钠有漂白性 C.
[实验与判断]请完成下列表格:
| 实验编号 |
1 |
2 |
3 |
| 实验装置 |
 |
 |
 |
| 验证猜想 |
|
C |
|
| 实验现象 |
溶液变红后不褪色 |
||
| 实验说明 |
1、2的实验中氢氧化钠溶液是用 (填“氢氧化钠固体”、“氧化钠固体”、“过氧化钠固体”)溶于水配制的。 |
(2)根据以上实验分析发现:过氧化钠与水反应过程中,钠元素形成了稳定的化合物,溶液中还生成了一种不很稳定、具有漂白性的物质X,X的化学式是 。
(3)可用右图装置对溶液中不很稳定的物质进行探究,在①处装入的物质是 (填选项,下同),②处装入的物质是 。
A.酚酞试剂
B.过氧化钠与水反应后的溶液
C.二氧化锰
D.氢氧化钠固体配制的溶液
(4)气体③是 ,过氧化钠与水反应的化学方程式没有写出X来,原因是 。
右图为实验室某浓盐酸试剂瓶标签上的有关数据u,试根据标签上的有关数据回答下列问题: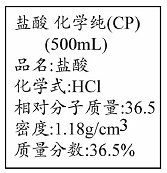
(1)该盐酸中HCl的物质的量浓度为
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是 。
A.溶液的浓度
B.溶液中氯化氢的物质的量
C.溶液中氯离子的数目
D.溶液的密度
(3)现用该浓盐酸配制250mL2mol/L的稀盐酸。可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤托盘天平;⑥玻璃棒。请回答下列问题:
①经计算,配制250ml2mol/L的稀盐酸需要用量筒量取上述浓盐酸的体积为 mL;
②配制稀盐酸时,还缺少的仪器有 (写出仪器名称及规格);
③对所配制的稀盐酸进行测定,发现其浓度小于2mol/L,引起误差的原因可能是 。
A.定容时俯视容量瓶刻度线
B.转移溶液后,未洗涤烧杯和玻璃棒
C.溶液注入容量瓶前没有恢复到室温就进行定容
D.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线
(4)若在标准状况下,将VL氯化氢气体溶于1L水中,所得溶于密度为dg/mL,则此溶液的物质的量浓度为 mol/L。
A.  B.
B. 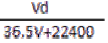 C.
C. 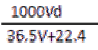 D.
D. 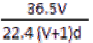
化学兴趣小组为了探究常温下某未知气体的成分。该小组成员将气体通入澄清石灰水,发现澄清石灰水变浑浊,持续通入发现浑浊又变澄清,由此该小组成员对气体的成分提出猜想。
[提出猜想]
猜想1:该气体为CO2。
猜想2: 。
猜想3:该气体为CO2和SO2的混合气体。
为了验证猜测,该小组设计实验加以探究:
[实验探究]
该小组同学按如图所示装置,将气体从a端通入,则: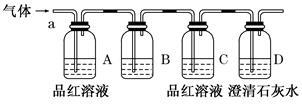
(1)B中应该装下列 试剂(填编号)。
| A.NaOH溶液 | B.酸性KMnO4溶液 |
| C.盐酸 | D.澄清石灰水 |
(2)B中溶液的作用是: 。
(3)D中澄清石灰水的作用是: 。
(4)通过该实验,该小组同学观察到以下三个实验现象:
①A中品红溶液褪色 ②C中品红溶液不褪色 ③D中澄清石灰水变浑浊
[得出结论]由上述现象该小组同学得出的结论为: 。