一定温度下,有可逆反应:2A(g)+2B(g)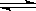 C(g)+3D(g)ΔH<0。现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图所示),保持反应过程中两容器的温度与起始时相同。
C(g)+3D(g)ΔH<0。现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图所示),保持反应过程中两容器的温度与起始时相同。
下列说法正确的是 ( )
| A.甲、乙两容器中的反应达到化学平衡时,C的体积分数相等 |
| B.甲、乙两容器中的反应达到化学平衡时,两容器内压强不相等 |
| C.向甲容器中再充入2molA和2molB,平衡后甲中物质C的浓度不变 |
| D.向乙容器中再充入2molC和6molD,平衡后乙中物质C的浓度为原来的2倍 |
用下图所示实验装置进行相应实验,能达到实验目的的是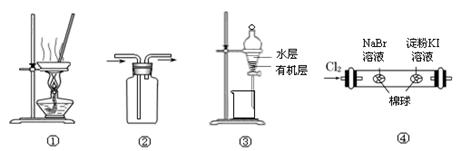
| A.用图①所示装置,蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
| B.按装置②所示的气流方向可用于收集H2、NH3等 |
| C.用图③所示装置,分离CCl4萃取I2水后的有机层和水层 |
| D.用图④所示装置,可以证明氧化性:Cl2>Br2>I2 |
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH =+49.0 kJ/mol
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ/mol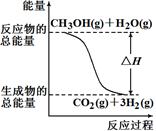
根据上述反应,下列说法正确的是
| A.上图表示反应①中的能量变化 |
| B.可推知2H2(g)+O2(g)=2H2O(g)ΔH=-483.8 kJ/mol |
| C.1 mol CH3OH充分燃烧放出的热量为192.9 kJ |
| D.CH3OH转变成H2的过程一定要吸收能量 |
在离子浓度均为0.1 mol·L-1的下列溶液中,加入(通入)某物质后,离子反应先后顺序正确是
| 选项 |
实验操作 |
反应先后顺序 |
| A |
含Fe3+、Cu2+、H+的溶液中加入锌粉 |
Cu 2+、Fe3+、H+ |
| B |
含I-、S2-、Br-的溶液中不断通入氯气 |
S2-、I-、Br- |
| C |
含Cl-、Br-、I-的溶液中逐滴加入AgNO3溶液 |
Cl-、Br-、I- |
| D |
含Al 3+、H+、NH4+ 的溶液中逐滴加入NaOH溶液 |
H+、NH4+、Al 3+ |
25℃时,下列溶液中,离子浓度关系正确的是
| A.pH=a的氨水稀释10倍后,其pH=b,则a=b+1 |
| B.浓度相同的①NH4Cl ②CH3COONH4 ③NH4HSO4,三种溶液中的c(NH4+):①>③>② |
| C.将相同浓度的氨水与盐酸等体积混合,所得溶液中的离子浓度关系:c (NH4+)> c (Cl-) > c (H+) > c (OH-) |
| D.将a mol·L-1CH3COOH与b mol·L-1NaOH溶液等体积混合,测得溶液pH为7,则a与b的关系:a>b |
下列解释实验事实的化学方程式或离子方程式不正确的是
A.氯气用于自来水的杀菌消毒:Cl2+H2O HCl+HClO HCl+HClO |
B.将“NO2球”浸泡在热水中,颜色变深:2NO2(g)  N2O4(g) N2O4(g)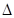 H<0 H<0 |
| C.向Ba(OH)2溶液中滴加NaHSO4溶液,至溶液呈中性:OH-+ Ba2++ H++SO42- = BaSO4↓+ H2O |
| D.铜片溶解在KNO3和稀硫酸的混合液中:3Cu + 8H+ + 2NO3- === 3Cu2+ + 2NO↑ + 4H2O |