已知25℃时,AgC1、AgBr、Agl的Ksp分别为1.8×l0-l0、5.O×10—13、8.3×10—17,用AgNO3标准溶液滴定卤素离子的过程,以滴入AgNO3溶液的体积为横坐标,pX为纵坐标:[pX= -lgc(X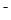 )],就可绘得滴定曲线。现以0.1 mol·L-l AgNO3溶液分别滴定20.00 mL 0.1 mol·L-lCl
)],就可绘得滴定曲线。现以0.1 mol·L-l AgNO3溶液分别滴定20.00 mL 0.1 mol·L-lCl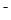 、Br
、Br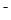 、I
、I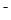 绘得滴定曲线如图,下列有关说法中正确的是
绘得滴定曲线如图,下列有关说法中正确的是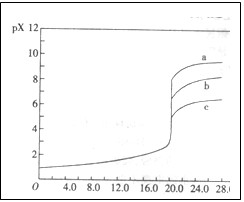
A.a、b、c分别表示Cl 、Br 、Br 、I 、I |
B.a、b、c分别表示I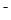 、Br 、Br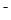 、Cl 、Cl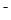 |
C.a、b、c分别表示Br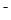 、I 、I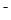 、Cl 、Cl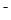 |
D.用硝酸银滴定法测定试样中c(Cl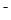 ),可用KI作指示剂 ),可用KI作指示剂 |
如图所示各为元素周期表的一部分,表中数字是原子序数,其中X为35的是
砷为第四周期第ⅤA族元素,依据它在周期表中的位置,推测砷不可能具有的性质
| A.砷在通常状况下为固体 |
| B.砷的最高正化合价为+5 |
| C.砷的最高价氧化物的水化物砷酸(H3AsO4)的酸性比磷酸(H3PO4)强 |
| D.砷化氢(AsH3)不如氨气(NH3)稳定 |
一种比黄金还要贵重百倍的 O2气体, 不久前在我国兰州近代物理研究所制备成功, 1 mol 这种
O2气体, 不久前在我国兰州近代物理研究所制备成功, 1 mol 这种 O2气体所含有的中子的物质的量为
O2气体所含有的中子的物质的量为
| A.36 mol | B.20 mol | C.16 mol | D.20 NA |
X是一种烃,它不能使KMnO4溶液褪色,0.5mol的X完全燃烧时,得到27g水和67.2LCO2(标准状况),X是
| A.苯 | B.环己烷 |
| C.1,3-丁二烯 | D.甲苯 |
下面有关电化学的图示,完全正确的是