化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的特殊情况。下列反应中属于这种情况的是
①过量的锌与18mol/L的硫酸反应;②过量的氢气与少量氮气在催化剂存在下充分反应;③浓盐酸与过量的MnO2;④过量铜与浓硫酸;⑤过量稀硝酸与银反应;⑥过量稀硫酸与块状石灰石
| A.②③④⑥ | B.②③⑤ | C.①④⑤ | D.①②③④⑤⑥ |
已知25℃、101kPa条件下:
4Al (s) + 3O2 (g) = 2Al2O3 (s)△H =-2834.9 kJ/mol
4Al (s) +2O3 (g) = 2Al2O3 (s)△H =-3119.91kJ/mol
由此得出的结论正确的是
| A.等质量的O2比O3能量低,由O2变O3为吸热反应 |
| B.等质量的O2比O3能量低,由O2变O3为放热反应 |
| C.O3比O2稳定,由O2变O3为吸热反应 |
| D.O2比O3稳定,由O2变O3为放热反应 |
已知反应:①101kPa时,C(s) + 1/2O2(g)=CO(g) △H1=-110.5kJ/mol
②稀溶液中,H+(aq) + OH-(aq)=H2O(1) △H2=-57.3kJ/mol
下列结论正确的是()
| A.若碳的燃烧热用△H3来表示,则△H3<△H1 |
| B.若碳的燃烧热用△H3来表示,则△H3>△H1 |
| C.浓硫酸与稀NaOH溶液反应的中和热为57.3kJ/mol |
| D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量 |
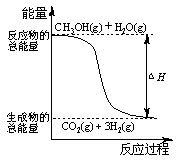
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=+49.0 kJ/mol
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9 kJ/mol
下列说法错误的是
| A.1mol CH3OH(g)完全燃烧放出的热量大于192.9 kJ |
| B.根据反应①和②推知反应: H2(g)+1/2O2(g)=H2O(g)的△H=-241.9kJ/mol |
| C.CH3OH转变成H2的过程不一定要吸收能量 |
| D.反应①中的能量变化如图所示 |
广义的水解观认为,无论是盐的水解还是非盐的水解,其最终结果都是反应中各物质和水分别解离成两部分,然后两两重新组合成新的物质。根据上述观点,下列说法中不正确的是
A.CaO2的水解产物是Ca(OH)2和H2O2 |
B.Al4C3的水解产物是Al(OH)3和甲烷 |
C.PCl3的水解产物是PH3和HClO  |
D.A1(C2H5)3的水解产物是Al(OH)3与C2H6 |
主链含5个碳原子,有甲基、乙基2个支链的烷烃有
| A.2种 | B.3种 | C.4种 | D.5种 |