下列离子方程式中正确的是
| A.向NaHSO4溶液中逐滴加入Ba(OH)2溶液,至SO42-沉淀完全; 2H++SO42-+Ba2++2OH-═BaSO4↓+2 H2O |
| B.碳酸钠与醋酸溶液反应:CO32-+2 H+═CO2+H2O |
| C.氢氧化亚铁与硝酸溶液混合:Fe(OH)2+2 H+═Fe2++2 H2O |
| D.在Ba(OH)2溶液中滴加少量NaHCO3溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O |
氮化硅(SiN4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
3SiO2+6C+2N2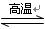 Si3N4+6CO。下列叙述正确的是()
Si3N4+6CO。下列叙述正确的是()
| A.在氮化硅的合成反应中,N2是还原剂,SiO2是氧化剂 |
| B.上述反应中每生成1molSi3N4,N2得到12mol电子 |
| C.若已知上述反应为放热反应,升高温度,其平衡常数增大 |
| D.若使压强增大,上述平衡向正反应方向移动 |
下列图示与对应的叙述相符的是()
| A.图5表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B.图6表示0.1000 mol·L-1NaOH溶液滴定20.00mL0.1000 mol·L-1CH3COOH溶液所得的滴定曲线 |
| C.图7表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液 |
| D.图8 表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时反应物转化率最大 |
短周期元素W、X、Y和Z的原子序数依次增大。元素W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍。下列说法错误的是()
| A.元素W、X的氯化物中,各原子均满足8电子的稳定结构 |
| B.元素X与氢形成的原子比为1:1的化合物有很多种 |
| C.元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 |
| D.元素Z可与元素X形成共价化合物XZ2 |
下列叙述正确的是()
A.Fe分别与氯气和稀盐酸反应所得氯化物相同
B.K、Zn分别与不足量的稀硫酸反应所得溶液均呈中性
C.Li、Na、K的原子半价和密度随原子序数的增加而增大
D.C、P、S、Cl的最高价氧化物对应水化物的酸性逐渐增强
Al、Fe、Cu都是重要的金属元素。下列说法正确的是()
| A.三者对应的氧化物均为碱性氧化物 |
| B.三者的单质放置在空气中均只生成氧化物 |
| C.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 |
| D.电解AlCl3、FeCl3、CuCl2的混合溶液是阴极上依次析出Cu、Fe、Al |