在下列物质转化关系中,反应的条件和部分产物已略去。已知甲、乙是两种常见金属,甲的焰色反应呈黄色,乙与H2O需要在高温下反应,反应Ⅲ是工业制盐酸的反应,则下列说法正确的是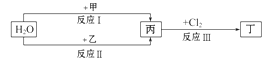
| A.工业上生产甲可以用热还原法 |
| B.反应Ⅱ的另外一种产物具有磁性 |
| C.向乙与Cl2反应产物的溶液中滴加KSCN溶液,无明显现象 |
| D.当有1mol乙参加反应Ⅱ时转移8mol电子 |
下列各组离子中,能在同一溶液中大量共存,加入一小块钠后仍能大量共存的是
| A.Na+、K+、Cl-、CO32- | B.Cu2+、Na+、SO42-、CO32- |
| C.Ba2+、K+、Cl-、SO42- | D.K+、Na+、HCO3-、NO3- |
下列操作正确的是
| A.有大量的氯气泄漏时,用肥皂水浸湿软布蒙面,并迅速离开现场 |
| B.金属钠着火时,立即用水灭火 |
| C.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
| D.用托盘天平称取5.85 g NaCl固体 |
“纳米材料”是粒子直径为1~100 nm(纳米)的材料,纳米碳就是其中的一种。若将纳米碳均匀地分散到蒸馏水中,所形成的物质
①是溶液②是胶体③能透过滤纸④不能透过滤纸
⑤能产生丁达尔效应⑥静置后,会析出黑色沉淀
| A.①④⑥ | B.②③④ | C.②③⑤ | D.①③④⑥ |
下列属于电解质的是
| A.NaCl溶液 | B.蔗糖 | C.CuSO4·5H2O | D.CO2 |
用NA表示阿伏伽德罗常数的值,下列说法正确的是
| A.在标准状况下,11.2 L H2O中含有的分子数为0.5 NA |
| B.32 g O2所含的原子数为2 NA |
| C.1 mol/L NaCl溶液中含有的Na+的数为NA |
| D.1 mol Na2O2中离子总数为4 NA |