在容积恒定的密闭容器中,存在下列平衡:2HBr(g) H2(g)+Br2(g)-Q,若升高温度,发生改变的是 ( )
H2(g)+Br2(g)-Q,若升高温度,发生改变的是 ( )
| A.分子数 | B.压强 | C.密度 | D.平均摩尔质量 |
将a g 含NaOH样品溶解在b mL 0.l mol·L-1的硫酸中,再加入c mL 0.1 mol·L-1 的氢氧化钡溶液,反应后所得溶液恰好呈中性,则样品中NaOH的纯度是
| A.[(b-c)/125a]×100% | B.[(b-2c)/125a]×100% |
| C.[(b-c)/250a]×100% | D.[(8b-8c)/a]×100% |
下列事实不能用勒夏特列原理解释的是
| A.打开碳酸饮料会有大量气泡冒出 |
| B.用难溶FeS固体除去工业废水中的Pb2+ |
| C.温度控制在500℃有利于合成氨反应 |
| D.实验室用排饱和食盐水的方法收集氯气 |
用物质的量均是0.1 mol的CH3COOH和CH3COONa配成1L混合溶液,已知其中c(CH3COO-)大于c(Na+),对该混合溶液的下列判断正确的是
| A.c(CH3COOH)>c(CH3COO-) |
| B.c(CH3COO-)+c(CH3COOH)=0.1 mol·L-1 |
| C.c(H+)>c(OH-) |
| D.c(CH3COO-)+c(OH-)=0.1mol·L-1 |
向三份0.1 mol·L-1Na2CO3溶液中分别加入少量NH4N O3固体、NaHCO3固体、HCl气体(忽略溶液体积变化),则CO32-浓度的变化依次为
O3固体、NaHCO3固体、HCl气体(忽略溶液体积变化),则CO32-浓度的变化依次为
| A.减小、增大、减小 | B.增大、减小、减小 |
| C.减小、增大、增大 | D.增大、减小、增大 |
向某密闭容器中充入1 mol CO和2 mol H2O(g),发生反应:CO+H2O(g) 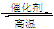 CO2+H2,当反应达到平衡时,CO的体积分数为x,若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是
CO2+H2,当反应达到平衡时,CO的体积分数为x,若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是
| A.0.5 mol CO+2 mol H2O(g)+1 mol CO2+1 mol H2 |
| B.1 mol CO+1 mol H2O(g)+1 mol CO2+1 mol H2 |
| C.0.5 mol CO+1.5 mol H2O(g)+0.4 mol CO2+0.4 mol H2 |
| D.0.5 mol CO+1.5 mol H2O(g)+0.5 mol CO2+0.5 mol H2 |