A、B、C、D、E、F、G、H、I、J均为有机化合物,根据以下框图,回答: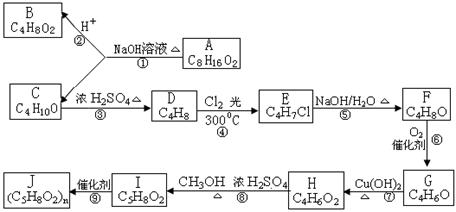
(1)B和C均为有支链的有机化合物,B的结构简式为________________________;C在浓硫酸作用下加热反应只能生成一种烯烃D,D的结构简式为________________________。
(2)G能发生银镜反应,也能使溴的四氯化碳溶液褪色,则G的结构简式为___________________________。
(3)写出⑤的化学反应方程式____________________________________________;⑨的化学反应方程式________________________________________________。
(4)写出下列反应的类型:①___________,⑦____________。
(5)与H具有相同官能团,且与H的同分异构体的所有物质结构简式为________________。
设反应①Fe(s)+CO2(g)  FeO(s)+CO(g) ΔH=Q1的平衡常数为K1,反应②Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH=Q1的平衡常数为K1,反应②Fe(s)+H2O(g) FeO(s)+H2(g) ΔH=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g) ΔH=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
| 温度(T) |
K1 |
K2 |
| 973 |
1.47 |
2.38 |
| 1 173 |
2.15 |
1.67 |
(1)从上表可推断,反应①是________(填“放”或“吸”)热反应。
(2)现有反应③H2(g)+CO2(g) CO(g)+H2O(g) ΔH=Q的平衡常数为K3。
CO(g)+H2O(g) ΔH=Q的平衡常数为K3。
Ⅰ.根据反应①与②推导出K1、K2、K3的关系式K3=________;可推断反应③是________(填“放”或“吸”)热反应。要使反应③在一定条件下建立的平衡右移,可采取的措施有________。
A.缩小容器体积 B.降低温度
C.使用合适的催化剂D.设法减少CO的量
E.升高温度
Ⅱ.根据反应①与②推导出Q1、Q2、Q3的关系式Q3=________。
25 ℃时,电离平衡常数:
| 化学式 |
CH3COOH |
H2CO3 |
HClO |
| 电离平衡常数 |
1.8×10-5 |
K1 4.3×10-7 K2 5.6×10-11 |
3.0×10-8 |
回答下列问题:
(1)物质的量浓度为0.1 mol/L的下列四种物质:a.Na2CO3、b.NaClO、c.CH3COONa、d.NaHCO3;pH由大到小的顺序是________________;(填编号)
(2)常温下0.1 mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是_____;
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.c(OH-)/c(H+)
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程pH变化如图,则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的平衡常数,理由是__________________,
稀释后,HX溶液中水电离出来的c(H+)________醋酸溶液中水电离出来的c(H+)(填“大于”、“等于”或“小于”),理由是:__________________;
(4)25 ℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=________。(填准确数值)
已知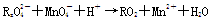 变化过程中,0.2 mol
变化过程中,0.2 mol 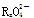 参加反应,共转移0.4 mol 电子。
参加反应,共转移0.4 mol 电子。
(1)反应的氧化产物为 。
(2)x=________。
(3)参加反应的氢离子的物质的量为________。
(4)配平题中的离子方程式并将配平后的式子写在下面横线上
A、B、C、D、E、F六种短周期元素,原子序数依次增大。A是地壳中含量最高的元素,C是地壳中含量最高的金属元素,A、E同主族。D元素原子最外层电子数是次外层电子数的一半。B、C两元素原子的最外层电子数之和等于D元素原子的最外层电子数,C、D两元素原子最外层电子数之和等于F元素原子的最外层电子数。
回答下列问题:
(1)元素A在元素周期表中的位置是。
(2)写出B、E两元素形成化合物的电子式:,所含化学键类型;
(3)A、D、E、F的气态氢化物的稳定性顺序(用化学式表示)
(4)写出C、E对应的最高价氧化物的水化物相互反应的化学方程式是:
(5)C、D的氧化物与分别与B的氢氧化物反应的离子方程式:、
大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究。
(1)在溶液中存在化学平衡:I2(aq)+I-(aq)
 (aq),其平衡常数表达式为________。
(aq),其平衡常数表达式为________。
(2)为探究Fe2+对O3氧化I-反应的影响(反应体系如图1),某研究小组测定两组实验中 浓度和体系pH,结果见图2和下表。
浓度和体系pH,结果见图2和下表。

①第1组实验中,导致反应后pH升高的原因是______________________________。
②图1中的A为________。由Fe3+生成A的过程能显著提高I-的转化率,原因是_________。
③第2组实验进行18 s后, 浓度下降。导致下降的直接原因有________。
浓度下降。导致下降的直接原因有________。
| A.c(H+)减小 | B.c(I-)减小 | C.I2(g)不断生成 | D.c(Fe3+)增加 |
(3)据图2,计算3~18 s内第2组实验中生成 的平均反应速率(写出计算过程,结果保留两位有效数字)。
的平均反应速率(写出计算过程,结果保留两位有效数字)。