某兴趣小组同学在实验室用加热l-丁醇、浓H2SO4和溴化钠混合物的方法来制备1-溴丁烷,设计了如下图所示的实验装置(其中的夹持仪器没有画出)。
请回答下列问题:
(1)A装置中,在烧杯里的液面倒扣一个漏斗,其目的是 ▲ 。
(2)制备操作中,加入的浓硫酸事先必须进行稀释,其目的是 ▲ 。(填字母)
a.减少副产物烯和醚的生 成 b.减少Br2的生成 c.水是反应的催化剂
成 b.减少Br2的生成 c.水是反应的催化剂
(3)有同学拟通过红外光谱仪鉴定所得产物中是否 含有“-CH2CH2CH2CH3”,来确定副产物中是否存在丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)。请评价该同学设计的鉴定方案是否合理?为什么?答: ▲ 。
含有“-CH2CH2CH2CH3”,来确定副产物中是否存在丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)。请评价该同学设计的鉴定方案是否合理?为什么?答: ▲ 。
(4)为了进一步提纯1-溴丁烷,该小组同学查得相关有机物的有关数据如下表:
| 物质 |
熔点/℃ |
沸点/℃ |
| 1-丁醇 |
-89.5 |
117.3 |
1-溴 丁烷 丁烷 |
-112.4 |
101.6 |
| 丁醚 |
-95.3 |
142.4 |
| 1-丁烯 |
-185.3 |
-6.5 |
则用B装置完成此提纯实验时,实验中要迅速升高温度至 ▲ 收集所得馏分。
某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如图工艺流程回收其中的镍制备硫酸镍晶体(NiSO 4•7H 2O ):

溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
|
金属离子 |
Ni 2+ |
Al 3+ |
Fe 3+ |
Fe 2+ |
|
开始沉淀时(c=0.01 mol•L ﹣ 1)的pH 沉淀完全时(c=1.0×10 ﹣ 5mol•L ﹣ 1)的pH |
7.2 8.7 |
3.7 4.7 |
2.2 3.2 |
7.5 9.0 |
回答下列问题:
(1)"碱浸"中NaOH的两个作用分别是 。为回收金属,用稀硫酸将"滤液①"调为中性,生成沉淀。写出该反应的离子方程式 。
(2)"滤液②"中含有的金属离子是 。
(3)"转化"中可替代H 2O 2的物质是 。若工艺流程改为先"调pH"后"转化",即  ,"滤液③"中可能含有的杂质离子为 。
,"滤液③"中可能含有的杂质离子为 。
(4)利用上述表格数据,计算Ni(OH) 2的K sp= (列出计算式)。如果"转化"后的溶液中Ni 2+浓度为1.0mol•L ﹣ 1,则"调pH"应控制的pH范围是 。
(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH.写出该反应的离子方程式 。
(6)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是 。
氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用如图装置(部分装置省略)制备
KClO 3和NaClO,探究其氧化还原性质。

回答下列问题:
(1)盛放MnO 2粉末的仪器名称是 ,a中的试剂为 。
(2)b中采用的加热方式是 。c中化学反应的离子方程式是 ,采用冰水浴冷却的目的是 。
(3)d的作用是 ,可选用试剂 (填标号)。
A.Na 2S B.NaCl C.Ca(OH) 2D.H 2SO 4
(4)反应结束后,取出b中试管,经冷却结晶, , ,干燥,得到KClO 3晶体。
(5)取少量KClO 3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入CCl 4振荡,静置后CCl 4层显 色。可知该条件下KClO 3的氧化能力 NaClO(填"大于"或"小于")。
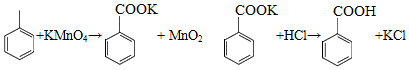
苯甲酸可用作食品防腐剂。实验室可通过甲苯氧化制苯甲酸,其反应原理简示如下:
|
名称 |
相对分子质量 |
熔点/℃ |
沸点/℃ |
密度/(g•mL﹣1) |
溶解性 |
|
甲苯 |
92 |
﹣95 |
110.6 |
0.867 |
不溶于水,易溶于乙醇 |
|
苯甲酸 |
122 |
122.4(100℃左右开始升华) |
248 |
﹣﹣ |
微溶于冷水,易溶于乙醇、热水 |
实验步骤:
(1)在装有温度计、冷凝管和搅拌器的三颈烧瓶中加入1.5mL甲苯、100mL水和4.8g (约0.03mol)高锰酸钾,慢慢开启搅拌器,并加热回流至回流液不再出现油珠。
(2)停止加热,继续搅拌,冷却片刻后,从冷凝管上口慢慢加入适量饱和亚硫酸氢钠溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣。合并滤液和洗涤液,于冰水浴中冷却,然后用浓盐酸酸化至苯甲酸析出完全。将析出的苯甲酸过滤,用少量冷水洗涤,放在沸水浴上干燥。称量,粗产品为1.0g。
(3)纯度测定:称取0.122g粗产品,配成乙醇溶液,于100mL容量瓶中定容。每次移取25.00mL溶液,用0.01000mol•L﹣1的KOH标准溶液滴定,三次滴定平均消耗21.50mL的KOH标准溶液。
回答下列问题:
(1)根据上述实验药品的用量,三颈烧瓶的最适宜规格为 (填标号)。
A.100mL B.250mL C.500mL D.1000mL
(2)在反应装置中应选用 冷凝管(填“直形”或“球形”),当回流液不再出现油珠即可判断反应已完成,其判断理由是 。
(3)加入适量饱和亚硫酸氢钠溶液的目的是 ;该步骤亦可用草酸在酸性条件下处理,请用反应的离子方程式表达其原理 。
(4)“用少量热水洗涤滤渣”一步中滤渣的主要成分是 。
(5)干燥苯甲酸晶体时,若温度过高,可能出现的结果是 。
(6)本实验制备的苯甲酸的纯度为 ; 据此估算本实验中苯甲酸的产率最接近于 (填标号)。
A.70% B.60% C.50% D.40%
(7)若要得到纯度更高的苯甲酸,可通过在水中 的方法提纯。
化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)氯气是制备系列含氯化合物的主要原料,可采用如图(a)所示的装置来制取。装置中的离子膜只允许 离子通过,氯气的逸出口是 (填标号)。

(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ[δ(X) ,X为HClO或ClO ﹣]与pH的关系如图(b)所示。HClO的电离常数K a值为 。
(3)Cl 2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl 2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl 2O的化学方程式为 。
(4)ClO 2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO 2、NaHSO 4、NaHCO 3的"二氧化氯泡腾片",能快速溶于水,溢出大量气泡,得到ClO 2溶液。上述过程中,生成ClO 2的反应属于歧化反应,每生成1mol ClO 2消耗NaClO 2的量为 mol;产生"气泡"的化学方程式为 。
(5)"84消毒液"的有效成分为NaClO,不可与酸性清洁剂混用的原因是 (用离子方程式表示)。工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000kg该溶液需消耗氯气的质量为 kg(保留整数)。
有机碱,例如二甲基胺(  )、苯胺(
)、苯胺(  )、吡啶(
)、吡啶(  )等,在有机合成中应用很普遍,目前"有机超强碱"的研究越来越受到关注。以下为有机超强碱F的合成路线:
)等,在有机合成中应用很普遍,目前"有机超强碱"的研究越来越受到关注。以下为有机超强碱F的合成路线:

已知如下信息:
①H 2C=CH 2

②  +RNH 2
+RNH 2

③苯胺与甲基吡啶互为芳香同分异构体
回答下列问题:
(1)A的化学名称为 。
(2)由B生成C的化学方程式为 。
(3)C中所含官能团的名称为 。
(4)由C生成D的反应类型为 。
(5)D的结构简式为 。
(6)E的六元环芳香同分异构体中,能与金属钠反应,且核磁共振氢谱有四组峰,峰面积之比为6:2:2:1的有 种,其中,芳香环上为二取代的结构简式为 。