下列叙述中,正确的是( )
| A.具有规则几何外形的固体一定是晶体 |
| B.晶体与非晶体的根本区别在于是否具有规则的几何外形 |
| C.具有各向异性的固体一定是晶体 |
| D.粉末状的物质不是晶体 |
冰醋酸加水稀释时,溶液中的氢离子浓度随加入的水量变化的下列各曲线图中,正确的是
下列事实可以证明一水合氨是弱电解质的是( )
①0.1 mol/L的氨水可使酚酞溶液变红 ②0.1 mol/L的氯化铵溶液的pH约为5 ③在相同条件下,氨水的导电性比强碱溶液弱 ④氨水受热分解挥发出氨气 ⑤在氨水中存在NH3·H2O分子
| A.①② | B.②③⑤ | C.③④ | D.②④ |
常温下,用0.100 0 mol·L–1NaOH溶液滴定20.00 mL 0.100 0 mol·L–1CH3COOH溶液,滴定曲线如图。下列说法正确的是( )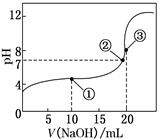
| A.点①所示溶液中:c(CH3COO–)+ c(OH–)= c(CH3COOH)+c(H+) |
| B.点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO–) |
| C.点③所示溶液中:c(Na+)>c(OH–)>c(CH3COO–)>c(H+) |
| D.滴定过程中可能出现:c(CH3COOH)>c(CH3COO–)>c(H+)>c(Na +)>c(OH-) |
某蓄电池放电、充电时反应为:Fe + Ni2O3 +3H2O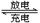 Fe(OH)2 +2Ni(OH)2,下列推断不正确的是
Fe(OH)2 +2Ni(OH)2,下列推断不正确的是
| A.放电时,Fe为正极,Ni2O3为负极 |
| B.充电时,阴极上的电极反应式是:Fe(OH)2 +2e–→Fe+2OH– |
| C.放电时,正极上的电极反应式是:Ni2O3 +3H2O+2e–→2Ni(HO)2 +2OH– |
| D.该蓄电池的电极必须是浸在某种碱性电解质溶液中 |
已知相同条件下,HClO的电离常数小于H2CO3的第一级电离常数(Ka1)大于H2CO3的第二级电离常数(Ka2)。为了提高氯水中HClO的浓度,可行的是( )
| A.通入HCl(g) | B.加入NaHCO3(s) | C.加入H2O | D.加入NaOH(s) |