将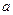 g金属钠投入到
g金属钠投入到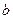 g水(足量)中。
g水(足量)中。
(1)所得溶液中溶质的质量分数为 ;
(2)能否求溶液中溶质的物质的量浓度?为什么?
 ;
;
(3)所得溶液中Na+与H2O的个数比为 。
烟气中NOx是NO和NO2的混合物(不含N2O4)。 (1)根据废气排放标准,1m3烟气最高允许含400 mg NOx。若NOx中NO质量分数为0.85,则1m3烟气中最高允许含NO__________L(标准状况,保留2位小数)。
(1)根据废气排放标准,1m3烟气最高允许含400 mg NOx。若NOx中NO质量分数为0.85,则1m3烟气中最高允许含NO__________L(标准状况,保留2位小数)。 (2)工业上通常用溶质质量分数为0.150的Na2CO3水溶液(密度1.16g/mL)作为NOx吸收剂,该碳酸钠溶液物质的量浓度为____________mol/L(保留2位小数)。
(2)工业上通常用溶质质量分数为0.150的Na2CO3水溶液(密度1.16g/mL)作为NOx吸收剂,该碳酸钠溶液物质的量浓度为____________mol/L(保留2位小数)。 (3)已知:
(3)已知: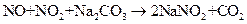 ①
①
 ②
②
1m3 含2000 mg NOx的烟气用质量分数为0.150的碳酸钠溶液吸收。若吸收率为80%,吸收后的烟气_______排放标准(填“符合”或“不符合”),理由:______________。
含2000 mg NOx的烟气用质量分数为0.150的碳酸钠溶液吸收。若吸收率为80%,吸收后的烟气_______排放标准(填“符合”或“不符合”),理由:______________。 (4)加入硝酸可改变烟气中NO和NO2的比,反应为:
(4)加入硝酸可改变烟气中NO和NO2的比,反应为: NO+2HNO3→3NO2+H2O
NO+2HNO3→3NO2+H2O 当烟气中
当烟气中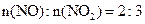 时,吸收率最高。
时,吸收率最高。
1m3烟气含2000 mg NOx,其中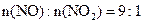 。
。 计算:①为了达到最高吸收率,1m3烟气需用硝酸的物质的量(保留3位小数)。
计算:①为了达到最高吸收率,1m3烟气需用硝酸的物质的量(保留3位小数)。 ②1m3烟气达到最高吸收率90%时,吸收后生成NaNO2的质量(假设上述吸收反应中,反应①比反应②迅速。计算结果保留1位小数)。
②1m3烟气达到最高吸收率90%时,吸收后生成NaNO2的质量(假设上述吸收反应中,反应①比反应②迅速。计算结果保留1位小数)。
2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题: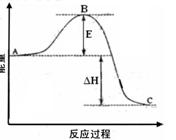
 (1)图中A.C分别表示.,E的大小对该反应的反应热有无影响?。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?,理由是;
(1)图中A.C分别表示.,E的大小对该反应的反应热有无影响?。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?,理由是; (2)图中△H=KJ·mol-1;
(2)图中△H=KJ·mol-1; (3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式; (4)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H
(4)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H
(写出计算过程)
有4种化合物W(通常状况下是气态).X(通常状况下是液态).Y、Z(通常状况下是固态),它们共由5种短周期元素A、B、C、D、E组成。已知:①原子序数A<B<C<D<E,且A与D同族;C与E同族;B与C同周期。②W由A和B组成,且W分子中,A与B的原子个数比为4∶1;X由A和C组成,且X分子中A与C的原子个数比为1∶1,Y由C和D组成,属离子化合物,且测得Y固体中C与D的原子个数比为1∶1。③Z由D和E组成,属离子化合物,且其阳离子比阴离子少1个电子层,阳离子数与阴离子数之比为2∶1。试推断写出:
(1)W的化学式是,W属于分子(填极性或非极性)。
(2)X的电子式是,X属于化合物。
(3)1 mol Y在干燥的空气中质量会(填“增大”或“减小”),其变化量(Δm)为。
(4)用电子式表示化合物Z的形成过程。
A.B.C.D.E.F六种短周期主族元素,原子序数依次增大。其中B的单质在常温下为双原子分子,它与A的单质可形成分子X,X的水溶液呈碱性;D的简单阳离子与X具有相同电子数,且D是同周期中简单离子半径最小的元素;E元素的原子最外层比次外层少两个电子, C.F两种元素的原子最外层共有13个电子。则
(1)B的原子结构示意图;X的分子构型;
(2)B.C.E分别与A形成的化合物中最不稳定的是(写化学式);
(3)C与D形成的化合物的化学式是,它的性质决定了它在物质的分类中应属于;请写出该化合物的水化物的电离方程式;
(4)F的单质在反应中常作剂,该单质的水溶液与E的低价氧化物反应的离子方程式为。
已知A-O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略去)。
A. B.H分别是由短周期元素组成的单质。B与冷水缓慢反应,与沸水迅速反应,放出氢气。D是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反就应得到两种碱。C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀。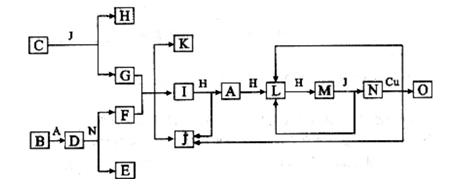
请回答下列问题:
(1)组成B单质的元素位于周期表第___周期,第____族。化合物C的电子式为______。
(2)通常情况下J为液体,用电子式表示其形成过程为_________________。
(3)写出I与H在点燃条件下反应生成A和J的化学方程式:________________。
(4)写出D与足量的N反应生成E和F的化学方程式:_____________________。