实验室配制 500 mL 0.2 mol/L CuSO4 溶液,实验操作步骤有:
溶液,实验操作步骤有:
①用天平称量蓝矾,把它放在烧杯里,用适量的蒸馏水使它完全溶解
②把制得的溶液小心地注入 500 mL 容量瓶中
③继续向容量瓶中加蒸馏水至液面距刻度 1~2 cm处,改用胶头滴管小心滴加少量蒸馏水至溶液凹液面底部与刻度线相切
④用少 量蒸馏水洗涤烧杯和玻璃棒 2~3 次,每次洗涤的液体都小心转入容量瓶,并轻轻摇动
量蒸馏水洗涤烧杯和玻璃棒 2~3 次,每次洗涤的液体都小心转入容量瓶,并轻轻摇动
⑤将容量瓶塞塞紧,充分摇匀
请填写下列空白:
(1)在天平上称出胆矾的质量为 g。
(2)操作步骤的正确顺序为 (填序号)。
(3)若出现如下情况,所配溶液浓度将有何影响?(填偏高、偏低或无影响)
a.没有进行操作步骤④时,会_______________;
b.定容时俯视刻度线,会__________________。
(4)若实验过程中出现如下情况应如何处理?
加蒸馏水时不慎超过了刻度,应  。
。
A、B、C、D、E、F 是常见单质,其中 A 是用量最大,应用最广泛的金属;元素 D 是地壳中含量最多的金属元素: D 元素和 E 元素在周期表中相邻, G、H、I、J、K、L 是常见化合物,其中 G 在常温下是无色液体, H 是黑色晶体,以上物质相互间的转化关系如下图所示: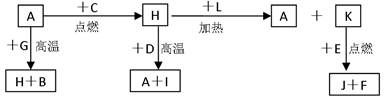
请回答下列问题:
(1)写出 A与FeCl3溶液反应的离子化学方程式_____________________________。
(2)写出 H 和 D 反应的化学方程式_______________________________。
(3)D 能与氢氧化钠溶液反应,请写出该反应的离子方程式:
_____________________________________________。
(4)写出 A 与 G 反应的化学方程式____________________________________。
(4)K 与 E 反应生成J和F,每生成1mol F放出热量为Q kJ,则该反应的热化学方程式为_______________________________________________。
(5)将FeCl3溶液滴入沸水中的现象为,离子方程式为,若加入少量的稀硫酸,现象为,继续加入大量稀硫酸,离子方程式为。
(1)如右图所示,用两根质量相等的银棒作电极电解CuCl2溶液,电解一段时间后,①现象为,
②a、b两极比较,极重,写出a极上发生的反应。
(2)下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5.00%的NaOH溶液、足量的CuSO4溶液和100g10.00%的K2SO4溶液,电极均为石墨电极。
I.接通电源,经过一段时间后,测得丙中K2SO4的浓度变为10.47%,乙中c电极质量增加。据此回答下列问题。
①电源的N端为极;
②电极b上发生的电极反应为:。
③电极b上生成的气体在标准状况下的体积为:L。
④电极c的质量变化是:g。
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液:,。
乙溶液:,。
丙溶液:,。
II.如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
,。
(12分)已知有以下物质相互转化
试回答:
(1)写出B的化学式,D的化学式。
(2)写出由E转变成F的化学方程式。
(3)检验G溶液中阳离子存在的试剂是_____________________。证明存在的现象是。向G溶液加入A的有关离子反应方程式_____________________________________________。
有一包白色固体,可能含有NaCl、Na2SO4、CaCl2、CuSO4、Na2CO3 和CaCO3 ,将固体放入水中,经搅拌后变为无色溶液,在溶液里加入BaCl2 溶液,产生白色沉淀,再加入盐酸,沉淀全部消失并有气体放出,由此推断:
(1)原固体肯定有______________。
(2)原固体肯定不存在。
(3)____________不能确定存在与否,要确定其存在,应进行的实验是___
。
已知X、Y、Z、W四种元素分别是元素周期表中三个短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍,试推断:
(1)X、Z二种元素的元素符号:X_________、Z__________。
(2)由以上元素中两两形成的化合物中:溶于水显碱性的气态氢化物的电子式为:,它的共价键属于(填:极性、非极性)键;含有离子键和非极性共价键的化合物的电子式为。
(3)由X、Y、Z所形成的常见离子化合物是___________,该化合物与W的最高价氧化物的水化物的浓溶液加热时反应的离子方程式为:_________________________ ;
X与W形成的化合物与水反应时,水作的是(填:氧化剂、还原剂)。