用下列实验装置或操作进行的实验能达到实验目的的是
取100 mL 2 mol/L和300 mL 1 mol/L的硫酸注入500 mL容量瓶中,加水稀释至刻度线,该混合溶液中H+的物质的量浓度是( )
| A.1.5 mol/L | B.2 mol/L | C.1.0 mol/L | D.1.6 mol/L |
下列说法中,不正确的是
| A.向沸水中逐滴加入适量FeCl3饱和溶液,煮沸至溶液呈红褐色,可制得Fe(OH)3胶体 |
| B.将Fe(OH)3胶体和泥水分别进行过滤,发现均不能通过滤纸孔隙 |
| C.胶体中分散质粒子的直径大小在1~100 nm之间 |
| D.可以利用丁达尔效应区分胶体和溶液 |
下列物质与反应的分类正确的是()
| A.纯碱、醋酸钠分别属于碱和盐 |
| B.钢和目前流通的硬币都是金属单质 |
| C.氯水和氨水都属于弱电解质 |
| D.铝与强酸、强碱的反应都是氧化还原反应 |
温度700℃ 时,向容积为2L的密闭容器中充入一定量的CO和H2O发生反应;
CO(g)+H2O(g) CO2+H2(g) ,反应过程中测定的部分数据见下表(表中t1<t2)。
CO2+H2(g) ,反应过程中测定的部分数据见下表(表中t1<t2)。
| 反应时间/min |
n(CO)/mol |
n(H2O)/ mol |
| 0 |
1.20 |
0.60 |
| t1 |
0.80 |
|
| t2 |
0.20 |
下列说法正确的是
A.反应在t1min内的平均速率为v(H2)=0.40/t1 mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时,n(CO2)=0.40 mol
C.保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小
D.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
常温下,向20.00 mL 0.100 mol·L-1CH3COONa溶液中逐滴加入0.100 mol·L-1盐酸,溶液的pH与所加盐酸体积的关系如图所示(不考虑挥发)。下列说法正确的是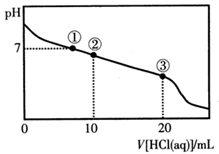
| A.点①所示溶液中:c(Na+)=c(Cl-)>c(H+)=c(OH-) |
| B.点②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH) |
| C.点③所示溶液中:c(Na+)>c(CH3COOH)>c(H+)>c(CH3COO-) |
| D.整个过程中可能出现:c(H+)+c(Na+)=c(CH3COO-)+c(CH3COOH) |