下列离子方程式书写正确的是
| A.氢氧化钠溶液中加入醋酸 H+ + OH- = H2O |
| B.向稀硫酸溶液中投入铁粉 2Fe +6H+ = 2Fe3+ +3H2 ↑ |
| C.向碳酸钠溶液中加入盐酸 CO32-+ 2H+ = H2O +CO2↑ |
| D.氧化铜溶于盐酸 O2-+ 2H+ = H2O |
某学生只有下列仪器和用具:烧杯、试管、硬质玻璃管、圆底烧瓶、量筒、铁架台(带铁夹)、酒精灯、集气瓶、玻璃片、水槽、导气管、橡皮塞、橡皮管、100mL容量瓶、玻璃棒、药匙、火柴。从缺少仪器或用品的角度看,该学生能进行的实验操作是
| A.制蒸馏水 |
| B.粗盐提纯 |
| C.用氢气还原氧化铜 |
| D.用氯化钠晶体配制100mL0.1mol·L—1的氯化钠溶液。 |
下列有关碳酸钠和碳酸氢钠的说法不正确的是
| A.在水中的溶解度:碳酸钠>碳酸氢钠 |
| B.热稳定性:碳酸钠>碳酸氢钠 |
| C.等物质的量的碳酸钠和碳酸氢钠分别与足量的盐酸反应,两者产生二氧化碳一样多 |
| D.足量的碳酸钠和碳酸氢钠分别与等物质的量的盐酸反应,两者产生二氧化碳一样多 |
金属钠分别投入下列溶液中,放出气体且最终不一定有沉淀的是
| A.MgCl2溶液 | B.CuSO4溶液 |
| C.FeCl3溶液 | D.Al2(SO4)3溶液 |
室温下,等质量的镁片和铝片分别与足量的稀硫酸反应,产生氢气的质量(m)与时间(t)的关系图正确的是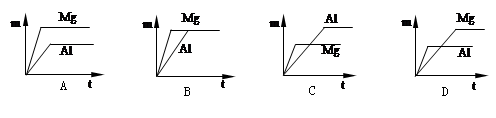
用NA表示阿伏加德罗常数,下列说法中正确的有
| A.56克亚铁离子得到2NA个电子被还原成单质 |
| B.1L 1mol/L的KCl溶液中含Cl-的物质的量为NA |
| C.在25℃、1.01×105Pa的条件下,2.24LCO2中含有的原子数大于0.3NA |
| D.0.1mol/L的氯化钡溶液中氯离子的数目是0.2NA |