下列是A、B、C、D、E、F、G、H及丙二酸(HOOCCH2COOH)间转化反应的关系图。A是一种链状羧酸,分子式为C3H4O2;F中含有由七个原子构成的环;H是一种高分子化合物。请填写下列空白:

写出下列反应的化学方程式和反应类型:
(1) A→H的化 学方程式: ,反应类型 。
学方程式: ,反应类型 。
(2) B与NaOH溶液反应的化学方程式: ,反应类型 。
(3)D+E→F的化学方程式: ,反应类型 。
(4)E→G的化学方程式: , 反应类型 。
反应类型 。
(5)G与银氨溶液反应的化学方程式:____________________________。
现有下列十种物质:
①H2②Cu③Na2O④CO2⑤H2SO4
⑥Ba(OH)2⑦红褐色的氢氧化铁胶体⑧碘酒⑨稀硝酸⑩Al2(SO4)3
(1)按物质的分类方法填写表格的空白处(填写序号):
| 分类标准 |
混合物 |
氧化物 |
电解质 |
| 属于该类的物质 |
(2)⑩在水中的电离方程式为。
(3)写出下列物质之间反应的离子方程式:
少量的④通入⑥的水溶液。
⑤的水溶液与⑥的水溶液混合。
(4)质量都是10 g的HCl、NH3、CO2、H2四种气体在标准状况下,体积最小的是;密度最小的是__ ____。(填分子式)
(5)②与⑨发生反应的化学方程式为:3Cu + 8HNO3 (稀) = 3Cu(NO3)2 + 2NO↑ + 4H2O,__ __ __是氧化剂,__ __ __元素被氧化,参加反应的HNO3中,n(HNO3)被还原∶n(HNO3)未被还原=,当有6.4gCu发生反应时,转移电子的物质的量为mol。
已知反应2HI(g)  H2(g) +I2(g)在T℃下的平衡常数为0.01。T℃时,在容积为2L的密闭容器中加入HI,反应到某时刻测得各组分的浓度如下:
H2(g) +I2(g)在T℃下的平衡常数为0.01。T℃时,在容积为2L的密闭容器中加入HI,反应到某时刻测得各组分的浓度如下:
| 物质 |
HI |
H2 |
I2 |
| 浓度/(mol·L-1) |
0.40 |
0.60 |
0.60 |
请计算回答下列问题(写出计算过程,否则不得分):
(1)起始加入HI的物质的量mol。
(2)达到平衡后HI的物质的量浓度mol·L-1(请保留三位有效数字)。
(3)T℃时,在另一个体积一定的密闭容器中,将I2(g)与H2(g) 置于其中发生上述反应,若达到平衡时H2(g)与I2(g)的体积比为1∶4,计算平衡时HI的体积分数为 ,以及开始时H2(g)与I2(g)的体积比为。
T℃时,容积固定为1L的密闭容器甲中充入2molSO2、1molO2,发生反应:2SO2(g) +O2(g)  2SO3(g)△H<0,维持温度为T℃,4min后达到平衡,测得平衡时n(SO3)=1.2mol。
2SO3(g)△H<0,维持温度为T℃,4min后达到平衡,测得平衡时n(SO3)=1.2mol。
(1)T℃时,该反应的平衡常数K的数值为。
(2)另有容器乙和丙均分别充入2molSO2、1molO2,起始容器容积与甲相同,起始温度均为T℃。在反应过程中乙容器保持温度和压强不变,丙容器保持容器体积不变并与外界绝热,分别建立平衡后:
①三个容器中反应的平衡常数K:K(甲)K(乙)K(丙)(选填“>”、“<”或“=”)。
②达到平衡时,甲、乙、丙三容器中,SO2的转化率α最小的是容器,混合气体密度ρ最大的是容器。
(3)若向上述容器甲的平衡体系中继续充入2mol SO2和1mol O2,在相同温度下再次达到平衡后,SO3的物质的量(填字母)。
a.2.4molb.大于1.2mol,小于2.4molc.大于2.4mol
合成氨是人类科学技术上的一项重大突破。
(1)NH3经一系列反应可以得到HNO3和NH4NO3。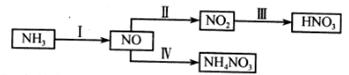
II中,2NO(g)+O2(g) 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线如下图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线如下图)。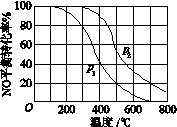
①随温度升高,该反应平衡向__________(选填“正反应”或“逆反应”)方向移动。
②比较P1、P2的大小关系:______________。
(2)一种工业合成氨的简易流程图如下: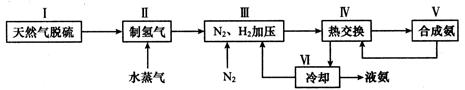
步骤II中制氢气原理如下:
a.CH4(g)+H2O(g) CO(g)+3H2(g)△H =" +206.4" kJ/mol
CO(g)+3H2(g)△H =" +206.4" kJ/mol
b.CO(g)+H2O(g) CO2(g)+H2(g)△H =" —41.2" kJ/mol
CO2(g)+H2(g)△H =" —41.2" kJ/mol
①对于反应a而言,增大CH4的浓度,达新平衡时H2的体积分数____增大(选填“一定”或“不一定”)。
②利用反应b,将CO进一步转化,可提高H2产量。若在500 ℃时,把等浓度的CO和H2O(g)充入反应容器,达到平衡时c(CO)=0.005 mol·L-1、c(H2)=0.015 mol·L-1,则CO的平衡转化率为。
③上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是(填序号),④简述一种本流程中可以提高合成氨原料总转化率的方法。
臭氧是一种强氧化剂,常用于消毒、灭菌等。
(1)O3可将KI氧化,生成的两种单质化学式为、。
(2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示: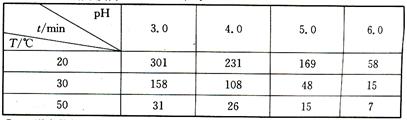
根据表中数据分析,pH升高,O3分解速率;温度升高,O3分解速率(选填“加快”或“减慢”)。
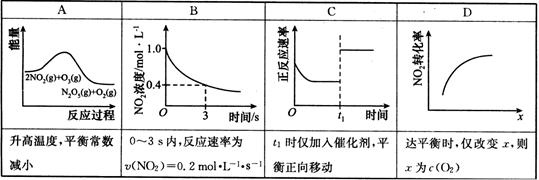
(3)臭氧是理想的烟气脱硝试剂,其脱硝反应为:2NO2(g)+O3(g)  N2O5(g)+O2(g)。若反应在恒容密闭容器中进行,下列相关图像正确的是(填字母)。
N2O5(g)+O2(g)。若反应在恒容密闭容器中进行,下列相关图像正确的是(填字母)。