氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,合成氨工业在国民生产中有重要意义。以下是关于合成氨的有关问题,请回 答:
答:
(1)若在一容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2在一定条件下发生反应:N2(g)+3H2(g) 2NH3(g) ΔH<0 ,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则前5分钟的平均反应速率v(N2)= 。平衡时H2的转化率为 %。
2NH3(g) ΔH<0 ,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则前5分钟的平均反应速率v(N2)= 。平衡时H2的转化率为 %。
(2)平衡后,若提高H2的转化率,可以采取的措施有 。
A.加了催化剂 B.增大容器体积
C.降低反应体系的温度 D.加入一定量N2
(3)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:
N2(g)+3H2(g) 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
| T/ ℃ |
200 |
300 |
400 |
| k |
K1 |
K2 |
0.5 |
请完成下列问题:
① 试比较K1、K2的大小,K1_______ K2 (填“<”“> ”或“=”);
”或“=”);
② 下列各项能作为判断该反应达到化学平衡状态的依据是________(填序号字母)
A、容器内N2、H2、NH3的物质的量浓度之比为1:3:2
B、v(N2)正=3 v(H2)逆
C、容器内压强保持不变
D、混合气体的密度保持不变
③400℃时,反应2NH3(g) N2(g)+3H2(g)的化学平衡常数为_______。当测得NH3、N2和H2的物质的量分别为3mol、2 mol和1 mol时,则该反应的
N2(g)+3H2(g)的化学平衡常数为_______。当测得NH3、N2和H2的物质的量分别为3mol、2 mol和1 mol时,则该反应的
v(N2)正______v(N2)逆 (填“<”“>”或“=”)。
(4)根据化学反应速率和化学平衡理论,联系合成氨的生产实际,你认为下列说法不正确的是_________。
A、化学反应速率理论可指导怎样在一定时间内快出产品
B、勒夏特列原理可指导怎样使用有限原料多出产品
C、催化剂的使用是提高产品产率的有效方法
D、正确利用化学 反应速率和化学反应限度理论都可以提高化工生产的综合经济效益
反应速率和化学反应限度理论都可以提高化工生产的综合经济效益
图是某课题组设计的合成聚酯类高分子材料 的路线:
的路线:
已知:①烃A的相对分子质量为106;
②同一碳原子上连两个羟基时结构不稳定,易脱水生成醛或酮:
③C可发生银镜反应。
请根据以上信息回答下列问题:
(1)A的结构简式为______________________。
(2)由A生成B的反应类型是________;由C生成D的反应类型是________。
(3)由B生成C的化学方程式为________________________________________________________,该反应过程中生成的不稳定中间体的结构简式应是________________________________________。
(4)D的分子式为________;D的同分异构体中,满足下列条件的有______________种。
①仅含有苯环,无其他环状结构;
②遇三氯化铁溶液显紫色;
③1mol能与3mol金属钠反应生成1.5mol氢气。
其中核磁共振氢谱表明分子中有四种氢,且其峰面积之比为3:2:2:1,请写出其结构简式:________。
已知A、B、C、D四种短周期元素,它们的核电荷数依次增大。A、C原子的L能层中都有两个未成对的电子,C、D同主族。E、F都是第四周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满。根据以上信息填空:
(1)基态E原子中,电子占据的最高能层符号为_______,该能层具有的原子轨道数为_______。
(2)E3+离子的价层电子排布式为______________。
(3)DCl2中D原子采取的轨道杂化方式为_________________________,C元素的气态氢化物的VSEPR模型名称为____________________________。
(4)写出一个与DAB-离子互为等电子体的合理分子式:__________________________。
(5)利用E(AB)63-检验E2+的离子方程式为_________________________。
(6)已知F的晶体结构为面心立方,F的原子直径d= 0.256nm,求1cm3 F中,含有F原子的个数约为_______________个。(保留3位有效数字)
淡水是一种重要的自然资源,是人类赖以生存不可缺少的物质。按要求回答下列问题:
(1)水质优劣直接影响人体健康。天然水在净化处理过程中加入的混凝剂可以是___________(填一种物质的名称),其净水作用的原理是_________________________ ____。混凝剂难以清除溶解于水中的有机物、无机物、微生物,混凝剂沉淀后还需要_____________。
(2)硬水的软化指的是_________________________ ____________________________ ___。
(3)硬度为1°的水是指每升水含10mg CaO或与之相当的物质(如7.1mg MgO)。若某天然水中c(Ca2+)=1.2×10-3mol/L,c(Mg2+)=6×10-4mol/L,则此水的硬度为_____________。
(4)若(3)中的天然水还含有c(HCO3-)=8×10-4mol/L,现要软化10m3这种天然水,则需先加入Ca(OH)2____________g, 后加入Na2CO3___________g 。
(5)如图是电渗析法淡化海水的原理图,其中,电极A接直流电源的正极,电极B接直流电源的负极。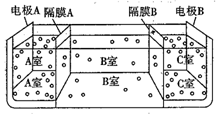
①隔膜A是_________(填“阴”或“阳”)离子交换膜。
②某种海水样品,经分析含有大量的Na+、Cl-,以及少量的K+、SO42-。若用上述装置对该海水进行淡化,当淡化工作完成后,A、B、C三室中所得溶液(或液体)的pH分别为pHa、pHb、pHc,则其大小顺序为________________________。
可逆反应mA(g)+nB(g) pC(g)+ qD(g)△H="a" KJ/mol,反应时间与C%(产物C的体积分数)函数关系如图13所示。
pC(g)+ qD(g)△H="a" KJ/mol,反应时间与C%(产物C的体积分数)函数关系如图13所示。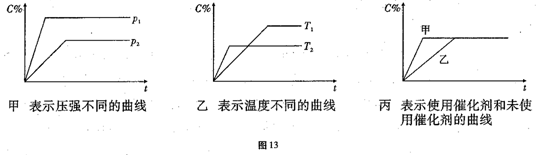
(1)据上述信息试比较下列大小关系:P1_______ P2,T1_______T2,△H_____0,△S_____0(增色填“﹥”“﹤”或“=”),图丙中使用催化剂的是_______反应线。
(2)该反应在_______(填“高温”或“低温”)下能自发进行。
(3)当该反应在两个体积相等的恒容密闭容器中进行反应时,如图:
请分析丙容器和丁容器达到平衡时C%(产物C的体积分数)是否可能相等,_____ (填“能”或“不能”),其原因是_____ _____ _____ 。
(4)假设第(3)问中,图中物质的量不变,在相同温度下达到平衡时丁中A、B的浓度分别是丙中A、B的浓度的ω倍,求m:n的值为 。
磷化铝是用红磷和铝粉烧制而成。因杀虫效率高、经济方便而应用广泛。可作粮仓熏蒸的磷化铝片,熏蒸每吨粮食只需3~5片(3.20g/片)。
(1)写出磷化铝的化学式:________;举一例红磷的同素异形体,写出其化学式:________。
(2)磷化铝毒性主要为遇水、酸时则迅速分解,放出吸收很快、毒性剧烈的磷化氢气体,写出磷化铝
和水反应的化学方程式:____________________________________________________________。
(3)磷化氢是一种无色、剧毒、易燃的气体,该气体比空气重并有类似臭鱼的味道,其结构和NH3相似,写出磷化氢的电子式:________;磷化氢具有强的还原性,通入硫酸铜溶液中会生成单质铜和磷酸,写出该反应的离子方程式:___________________________________________。
(4)磷化氢在空气中的最高允许值为0.3ppm,空气中超标的PH3气体可以用重铬酸钾、活性炭、氢碘酸处理,你认为他们的反应原理是否相同,原因是____________________________________。
(5)磷的含氧酸很多,H3PO4是常见的一种,多个磷酸分子通过脱水作用由O原子连接而成为多磷酸,三聚磷酸钠(Na5P3O10·6H2O)是常见的多磷酸盐,该盐373K时,可发生如下反应Na5P3O10·6H2O="==" Na3HP2O7+X+5H2O,请你推出X的化学式:__________________;并且写出X溶液中离子电荷守恒的等式:___________________________。