科学家发现,食用虾类等水生加壳类动物的同时服用维生素C容易中毒。这是因为对人体无害的+5价砷类化合物在维生素C的作用下,能够转化为有毒的+3价的含砷化合物。下列说法中不正确的是( )
| A.维生素C具有还原性 | B.1mol+5价砷完全转化为+3价砷,共失去2mol电子 |
| C.上述过程中+5价砷元素发生还原反应 | D.上述过程中+5价砷类物质作为氧化剂 |
在一定温度不同压强(P1<P2)下,可逆反应2X(g) 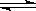 2Y(g) + Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是
2Y(g) + Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是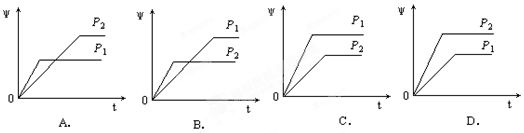
在温度压强不变时,1mol NO2高温分解,生成NO和O2,达到平衡时容器内气体的物质的量变为1.2mol,这时NO2的转化率为
| A.10% | B.20% | C.40% | D.50% |
在一定温度下的密闭容器中发生某一反应,M、N的物质的量随反应时间变化的曲线如下图,下列表述正确的是( ) 
A.反应的化学方程式为2M N N |
| B.t2时,正、逆反应速率相等,达到平衡 |
| C.t3时,正反应速率大于逆反应速率 |
| D.t1时,N的浓度是M浓度的2倍 |
在密闭容器中,一定量的混合气体发生反应:xA(g)+yB(g) zC(g)
zC(g)
平衡时测得A的浓度为0.50m ol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.20mol/L。下列有关判断正确的是( )
ol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.20mol/L。下列有关判断正确的是( )
| A.x+y>z |
| B.平衡向正反应方向移动 |
| C.B的转化率降低 |
| D.C的体积分数下降 |
在一固定容积的密闭容器中,放入3 L气体X和2 L气体Y,在一定条件下发生下列反应:4X(g)+3Y(g) 2Q(g)+nR(g)达平衡后,容器内温度不变,混合气体的压强比原来增大了5%,X的浓度减小
2Q(g)+nR(g)达平衡后,容器内温度不变,混合气体的压强比原来增大了5%,X的浓度减小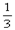 。则此反应中n值是( )
。则此反应中n值是( )
| A.3 | B.4 | C.5 | D.6 |