甲、乙两同学为探究 与可溶性钡的强酸盐能否反应生成白色
与可溶性钡的强酸盐能否反应生成白色 沉淀,用下图所示装置进行实验(夹持装置和A中加执装置已略,气密性已检验)
沉淀,用下图所示装置进行实验(夹持装置和A中加执装置已略,气密性已检验) 
实验操作和现象:
| 操作 |
现象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 |
A.中有白雾生成,铜片表面产生气泡 B.中有气泡冒出,产生大量白色沉淀 C.中产生白色沉淀,液面上方略显红棕色并逐渐消失 |
打开弹簧夹,通入 ,停止加热,一段时间后关闭 ,停止加热,一段时间后关闭 |
|
| 从B、C中分别取少量白色沉淀,加稀盐酸 |
均未发现白色沉淀溶解 |
(1)A中反应的化学方程式是  。
。
(2)C中白色沉淀是 。
(3)C中液面上方生成红棕色气体的化学方程式是 。
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲同学认为是空气中的氧气参与反应,乙同学认为是白雾(硫酸酸雾)参与反应。
①为证实各自的观点,在原实验基础上;甲同学在原有操作之前通 一段时间,目的是 。乙同学在A、B间增加盛有饱和
一段时间,目的是 。乙同学在A、B间增加盛有饱和 溶液的洗气瓶D,D中反应的离子方程式是 。
溶液的洗气瓶D,D中反应的离子方程式是 。
②各自进行实验,B中现象:
| 甲 |
大量不溶于稀盐酸的白色沉淀 |
| 乙 |
少量不溶于稀盐酸的白色沉淀 |
用离子方程式解释乙同学观察到的实验现象 

(不必配平)。
(5)若将(4)中两同学的方案进行联合试验,发现B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是 。
工业制备的高锰酸钾是锰的重要化合物和常用的氧化剂。以下附图是工业上用软锰矿制备高锰酸钾的一种工艺流程。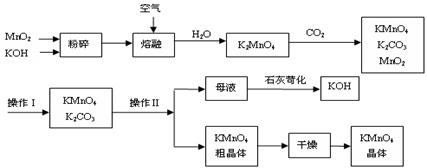
⑴KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是_____(填代号)。
a.84消毒液(NaClO溶液) b.双氧水 c.苯酚 d.75%酒精
⑵上述流程中可以循环使用的物质有 、 (写化学式)。
⑶若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得 mol KMnO4。
⑷操作Ⅰ的名称是_____________;操作Ⅱ是根据KMnO4和K2CO3两物质在__________(填性质)上差异 ,采用____________(填操作步骤)、趁热过滤得到KMnO4粗晶体的
,采用____________(填操作步骤)、趁热过滤得到KMnO4粗晶体的
请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式:
(1)_________+__________→__________+__________+__________+H2O
(2)反应物中发生氧化反应的物质__________,被还原的元素是_________。
(3)反应中1 mol氧化剂_______(填“得到”或“失去”)___________ mol电子。
(4)请将反应物的化学式及配平系数填入下列相应的位置中
下列有关实验操作中,正确的是
| A.沾附在试管内壁上的油脂,用热碱液洗涤 |
| B.除去苯中含有的苯酚,先加浓溴水再过滤。 |
| C.检验卤代烃中的卤素原子,先将卤代烃与NaOH溶液共热,再加AgNO3溶液 |
| D.除去乙酸乙酯中的乙酸,加入氢氧化钠溶液。 |
E.检验淀粉的水解产物,先将淀粉与稀硫酸共热一段时间,然后加入氢氧化钠中和硫酸,再加入银氨溶液并水浴加热。
与甲醇燃料电池相比,乙醇燃料电池具有毒性低、理论能量密度高等优点,因此被广泛认为是更有前途的燃料电池。下图是一个乙醇燃料电池工作时的示意图。乙池中的两个电极均为石墨电极,乙池中盛有100 mL3.00 mol/L的CuSO4溶液。请回答下列问题: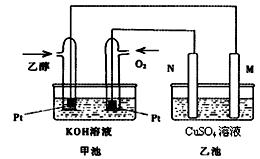
(1)在常温常压下,1g C2H5OH燃烧生成CO2和液态H2O时放出30kJ热量,表示该反应的热化学方程式为。
(2)N的电极反应式为。
(3)在此过程中,乙池中某一电极析出金属铜6.4g时,甲池中理论上消耗氧气升
(标准状况下)
(4) 在此过程中,若乙池中两电极产生的气体恰好相等时(假设标准状况 下),理论上需通入乙醇g?
下),理论上需通入乙醇g?
已知1 molCO气体完全燃烧生成CO2 气体放出283 kJ热量;1 mol氢气完全燃烧生成液态水放出286 kJ热量;1 molCH4气体完全燃烧生成CO2气体和液态水放出890 kJ热量。
(1)若1 molCH4气体完全燃烧生成CO2气体和水蒸气,放出热量为890 kJ(填“>”、 “<”、“= ”)。
(2)若将a molCH4、CO和H2的混合气体完全燃烧,生成 CO2气体和液态水时,则放出热量(Q)的 取值范围是。
取值范围是。
(3)若将a molCH4、CO和H2的混合气体完全燃烧,生成 CO2气体和液态水,且CO2和水的物质的量相等时,则放出热量(Q)的取值范围是___________________________。