 在K2Cr2O7 + 14HCl="2KCl" + 2CrCl3 + 3Cl2↑+7H2O反应中,_________元素被氧化,_________是氧化剂,还原产物是 ,电子转移的数目是_________。
在K2Cr2O7 + 14HCl="2KCl" + 2CrCl3 + 3Cl2↑+7H2O反应中,_________元素被氧化,_________是氧化剂,还原产物是 ,电子转移的数目是_________。
(1)在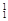 H,
H,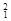 H,
H,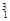 H,
H,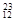 Mg,
Mg,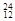 Mg,
Mg,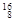 O,
O,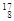 O,
O,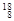 O中共有______种元素,______种原子,中子数最多的是。D218O的相对分子质量是______。
O中共有______种元素,______种原子,中子数最多的是。D218O的相对分子质量是______。
(2)人类的生活和生产活动,都离不开能源。在石油、电能、风能、煤碳、天然气、秸杆、水力、水煤气这些能源中,属于“二次能源”的(两种)是____,_(共1分)属于“不再生能源”的(三种)是___,,_(共1分)。
(3)化学反应的限度是当______和__相等,反应物和生成物的 _____保持不变时,所达到的一种看似 的“平衡状态”。
(6分)现有反应:CO(g)+ H2O(g) CO2(g)+ H2(g) ;△H<0,在850℃时,平衡常数K=1。
CO2(g)+ H2(g) ;△H<0,在850℃时,平衡常数K=1。
(1)若升高温度到950℃时,达到平衡时K_____1(填“大于”、“小于”或“等于”)
(2)850℃时,若向一容积可变的密闭容器中同时充入 1.0 mol CO、3.0molH2O、1.0mol CO2 和 x molH2,则:
①当x=5.0时,上述平衡向_______(填正反应或逆反应)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是________。
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇和水,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的热值分别为143kJ· g-1、10kJ·g-1和23kJ·g-1。请回答下列问题:
(1)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_______;
(2)在直接以甲醇为燃料电池中,电解质溶液为碱性,负极的反应式为_____, 总反应式。
(3)在350℃时,保持温度不变,将1molCO2和3molH2充入一密闭恒容器中,充分反应生成甲醇蒸汽和水蒸气达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为______;若350℃时,保持温度不变,将1molCO2和3molH2充入一密闭恒压器中,充分反应达到平衡后,若CO2转化率为b,则ab(用“>、=、<”表示)
已知碱存在下,卤代烃与醇反应生成醚(R1—O--R2):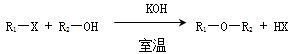
化合物A经下列四步反应可得到常见溶剂四氢呋喃,反应框图如下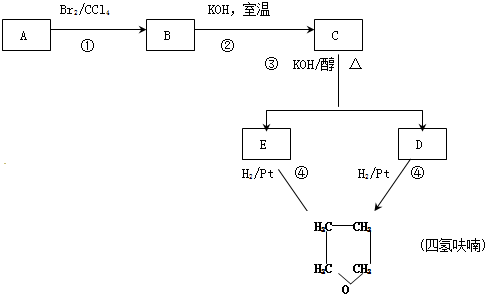
请回答下列问题:
(1)1molA和1molH2在一定条件下恰好反应,生成饱和一元醇Y,Y中碳元素的质量分数约为65%,则Y的分子式为,A中所含官能团的名称是A的结构简式
(2)第①③步反应类型是①③
(3)已知E的核磁共振氢谱中出现两组峰,写出C生成E的化学方程式
(4)A有很多异构体,其中能和氢氧化铜反应生成红色沉淀的有种
.(4分)已知某有机物只含C、H、O三种元素。取6.2 g该有机物,在氧气中完全燃烧,产生CO2和H2O分别为8.8 g和5.4 g,通过计算,可获得该有机物的实验式为__________。其分子式为____________。(如能确定分子式填此空,如不能确定分子式则不填此空)