(1)同温同压下,同体积的甲烷(CH4)和CO2气体的分子数之比为 ;质量比为 ;原子总数之比为 ;氢原子数与氧原子数之比为 。
(2)已知N2、CO2的混合气体的质量共12.0克,标准状况下 ,体积为6.72L,该混合气体的平均摩尔质量为 ;原混合气体中N2、CO2的体积之比为 。
,体积为6.72L,该混合气体的平均摩尔质量为 ;原混合气体中N2、CO2的体积之比为 。
根据已学知识,请你回答下列问题:
(1)写出原子序数最小的第Ⅷ族元素原子的原子结构示意图为:__________。
(2)写出3p轨道上有2个未成对电子的元素的符号:______________。
(3)该元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4,该元素的的名称是____________.
(4)第三主族的元素由于最外能层的p能级中有空轨道,故称为缺电子元素。硼酸的结构式可表示为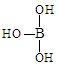 ,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:
,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:
(5)已知:下列化学键的键能(KJ/mol),Si—O;460,Si—Si:175,O=O:498,则反应Si+O2= SiO2的反应的△H=_________
通过粮食发酵可获得某含氧有机化合物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%。
(1)X的分子式是________________;
(2)由粮食发酵获得X的化学变化过程中,最主要的两个化学方程式是:
, ;
;
(3)X与金属钠反应放出氢气,反应的化学方程式是 。
。
有机物A为茉莉香型香料。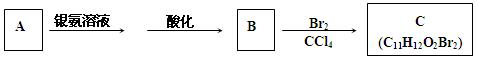
(1)A分子中含氧官能团的名称是。
(2)C的分子结构可表示为如下图(其中R代表烃基)。 A分子结构中只有一个甲基,A的结构简式是。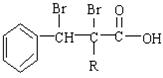
(3)B不能发生的反应是(填编号)。
| A.氧化反应 | B.加成反应 | C.取代反应 | D.水解反应 |
(4)在浓硫酸存在下,B与乙醇共热生成化合物
C13H16O2的化学方程式是。
(5)在催化剂作用下,B发生聚合反应生成聚合物的化学方程式是
。
(共10分)根据下面的反应路线及所给信息填空。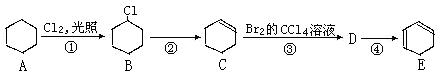
Ⅰ、②的反应条件是____;B的名称是_____;
Ⅱ、①的反应类型是 。④的反应类型是。
。④的反应类型是。
Ⅲ、写出D在NaOH溶液里发生的化学反应方程式:。
已知25℃时部分弱电解质的电离平衡常数数据如下表: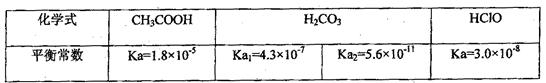
回答下列问题:
( 1)物质的量浓度均为0.1mol·L-1的四种溶液:a.CH3COOH b.Na2CO3 c.NaClO
1)物质的量浓度均为0.1mol·L-1的四种溶液:a.CH3COOH b.Na2CO3 c.NaClO d.NaHCO3;pH由小到大的排列顺序是(用字母表示)
d.NaHCO3;pH由小到大的排列顺序是(用字母表示)
(2)常温下,0.1mol·L-1的CH3COOH溶液加稀释过程中,下列表达式的数据变大的是
| A.c(H+) | B.c(H+)/c(CH3COOH) |
| C.c(H+)·c(OH-) | D.c(OH-)/c(H+) |
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示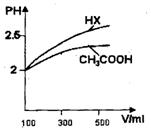
则 HX的电离平衡常数CH3COOH的
HX的电离平衡常数CH3COOH的 电离平衡常数(填大于、小于或等于)理由是
电离平衡常数(填大于、小于或等于)理由是
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)—c(Na+)=mol·L-1(填精确值),c(CH3COO-)/c(CH3COOH)=