I.冠心平F是降血脂、降胆固醇的药物,它的一条合成路线如下: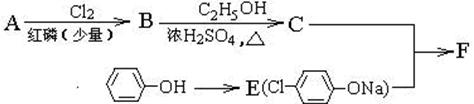

(注:R表示烃基或H原子)
⑴ A为羧酸,其分子式为C4H8O2,8.8gA与足量NaHCO3溶液反应生成 L CO2(标准状况,不考虑CO2溶于水)。
⑵写出符合A分子式羧酸类物质的结构简式: 。
⑶已知A→B属于取代反应,B为一卤代羧酸,其核磁共振氢谱只有两个峰,写出B→C的反应方程 式: 。
式: 。 ⑷写出F的结构简式: 。
⑷写出F的结构简式: 。
II.按如下路线,由C可合成酯类高聚物H:
C G H
H
⑸写出G→H的反应方程式: 。
某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A====H++HA- HA- H++A2-
H++A2-
试完成下列问题:
(1)Na2A溶液显_______(填“酸性”“中性”或“碱性”)。
理由是___________________________________________(用离子方程式表示)。
(2)在0.1 mol·L-1的Na2A溶液中,下列粒子浓度关系式正确的是_________。
A.c(A2-)+c(HA-)+c(H2A)="0.1" mol·L-1
B.c(OH-)=c(H+)+c(HA-)
C.c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-)
D.c(Na+)=2c(A2-)+2c(HA-)
(3)已知0.1 mol·L-1NaHA溶液的pH=2,则0.1 mol·L-1 H2A溶液中氢离子的物质的量浓度可能是0.11 mol·L-1_________ (填“<”“>”或“=”),理由是____________________________________。
(4)0.1 mol·L-1 NaHA溶液中各种离子浓度由大到小的顺序是:__________________________。
已知某浓度的硫酸在水中的电离方程式:
H2SO4====H++HSO-4,
 H++
H++ 。
。
(1)Na2SO4溶液显________(填“酸性”“碱性”或“中性”),理由是(用离子方程式表示)_________。
(2)在25 ℃时0.1 mol·L-1的NaHSO4溶液中c( )="0.029" mol ·L-1,则25 ℃时,0.1 mol·L-1 H2SO4溶液中c(
)="0.029" mol ·L-1,则25 ℃时,0.1 mol·L-1 H2SO4溶液中c( )________(填“大于”,“小于”或“等于”)0.029 mol ·L-1,理由是__________。
)________(填“大于”,“小于”或“等于”)0.029 mol ·L-1,理由是__________。
(3)在0.1 mol ·L-1 Na2SO4溶液中,下列粒子浓度关系正确的是()
A.c(Na+)+c(H+)=c(OH-)+c(HSO-4)+2c( ) ) |
B.2c (Na+)=c( )+c(HSO-4) )+c(HSO-4) |
C.c(Na+)>c( )>c (H+)>c (OH-) )>c (H+)>c (OH-) |
D.c( )+c(HSO-4)="0.1" mol·L-1 )+c(HSO-4)="0.1" mol·L-1 |
(1)加热蒸干Al2(SO4)3(aq),得到的固体物质是______________________(写化学式)。
(2)加热蒸干NaHCO3(aq),得到的固体物质是______________________(写化学式)。
(3)加热蒸干Na2SO3(aq),得到的固体物质是______________________(写化学式)。
(6分) “神舟”7号宇宙飞船是靠长征Ⅱ(F)型运载火箭发射升空的。该火箭所用的燃料是偏二甲肼〔(CH3)2N—NH2〕,氧化剂是N2O4,产物是氮气、二氧化碳和水。
(1)火箭点火瞬间,逸出的红棕色气体是_______,产生该气体的化学反应方程式为
_________。
(2)偏二甲肼在N2O4中燃烧的化学方程式为_________________________,当有1 mol偏二甲肼燃烧时,转移电子的物质的量为___________。
图示表示800℃时A、B、C三种气体物质的浓度随时间的变化情况,t1是到达平衡状态的时间.试回答: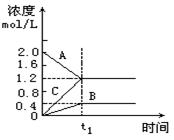
(1)该反应的反应物是____ __;
(2)反应物的转化率是______;
(3)该反应的化学方程式为______.