用下列几个实验,可快速制取实验室所需的少量气体,并进行相关性质实验。(实验装置如右图所示)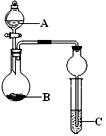
(1)若B中是生石灰,C中盛有AlCl3溶液,将A中液体逐滴加入B内,实验
中观察到C溶液中出现白色沉淀。则A中液体的是 (填名称)
C中发生反应的离子方程式为 。
(2)若要制O2,B为黑色固体,A中的试剂是 (填化学式),C中盛
有FeCl2和KSCN的混合液,旋开分液漏斗的开关后,发现C中溶液变为
血红色,写出C 中发生氧化还原反应的离子方程式 。
(3)已知氧化性强弱:KMnO4>Cl2>KIO3>I2。若A中装有浓盐酸,B中装有固体KMnO4,C中盛有KI淀粉溶液,C中的现象是 ,继续反应一段时间后,发现C中溶液的颜色褪去,这是因为
某化学实验小组为了验证SO2和Cl2的漂白性,设计了如下图所示的实验装置。请回答下列问题:
(1)他们制备SO2和Cl2所依据的原理分别是:Na2SO3+H2SO4=Na2SO4+H2O+SO2↑、MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,则上图A、E装置中用来制Cl2的装置是
MnCl2+Cl2↑+2H2O,则上图A、E装置中用来制Cl2的装置是
(填序号),反应中盐酸所表现的性质是;
(2)反应开始后,发现B、D试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的溶液加热,B试管中的现象是;
(3)装置C的作用是;
(4)NaOH(足量)溶液分别与两种气体反应的离子方程式是、;
(5)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色。查阅资料得知:两种气体按体积比1∶1混合,再与水反应可生成两种常见酸,因而失去漂白作用。该反应的化学方程式为。
滴定实验是化学学科中重要的定量实验。
请回答下列问题:
(1)酸碱中和滴定——用标准盐酸滴定未知浓度的NaOH溶液,下列操作造成测定结果偏高的是(填选项字母)
A.滴定终点读数时,俯视滴定管刻度,其他操作正确。
B.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,滴定管尖嘴有气泡,滴定后气泡消失
(2)氧化还原滴定——取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol·L-1的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。表格中记录了实验数据:
| 滴定次数 |
待测液体积 (mL) |
标准KMnO4溶液体积(mL) |
|
| 滴定前读数 |
滴定后读数 |
||
| 第一次 |
25.00 |
0.50 |
20.40 |
| 第二次 |
25.00 |
3.00 |
23.00 |
| 第三次 |
25.00 |
4.00 |
24.10 |
①滴定时,KMnO4溶液应装在(填“酸”或“碱”)式滴定管中,滴定终点时滴定现象是
②该草酸溶液的物质的量浓度为_____________。
(3)沉淀滴定――滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。
参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是(填选项字母)。
| 难溶物 |
AgCl |
AgBr |
AgCN |
Ag2CrO4 |
AgSCN |
| 颜色 |
白 |
浅黄 |
白 |
砖红 |
白 |
| Ksp |
1.77×10-10 |
5.35×10-13 |
1.21×10-16 |
1.12×10-12 |
1.0×10-12 |
A.NaCl B.NaBr C.NaCN D.Na2CrO4
某课外活动小组利用如下图所示的装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等固定装置已略去。实验时,先加热玻璃管中的铜丝,约1 min后鼓入空气。请填写下列空白: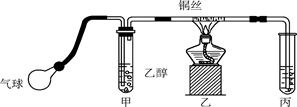
(1)检验乙醛的试剂是________(填字母)。
| A.银氨溶液 | B.碳酸氢钠溶液 | C.新制Cu(OH)2 | D.氧化铜 |
(2)乙醇发生催化氧化反应的化学方程式为:_____________________________。
(3)实验时,常常将甲装置浸在70~80 ℃的水浴中,目的是_______________________,由于装置设计上的缺陷,实验进行时可能会_________________________。
(4)反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行。进一步研究表明,鼓气速度与反应体系的温度关系曲线如图所示。试解释鼓气速度过快,反应体系温度反而下降的原因________________,该实验中“鼓气速度”这一变量你认为可用_________来估量。
(5)该课外活动小组偶然发现向溴水中加入乙醛溶液,溴水褪色。该同学为解释上述现象,提出两种猜想:①溴水将乙醛氧化为乙酸;②溴水与乙醛发生加成反应。请你设计一个简单的实验,探究哪一种猜想正确?_______________________________。
S2Cl2是工业上常用的硫化剂,实验室制备S2Cl2的方法有2种:
① CS2+3Cl2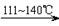 CCl4+S2Cl2;② 2S+Cl2
CCl4+S2Cl2;② 2S+Cl2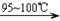 S2Cl2。
S2Cl2。
已知S2Cl2中硫元素显+1价,电子式: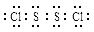 ,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低)。反应涉及的几种物质的熔沸点如下:
,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低)。反应涉及的几种物质的熔沸点如下:
| 物质 |
S |
CS2 |
CCl4 |
S2Cl2 |
| 沸点/℃ |
445 |
47 |
77 |
137 |
| 熔点/℃ |
113 |
-109 |
-23 |
-77 |
实验室利用下列装置制备S2Cl2(部分夹持仪器已略去):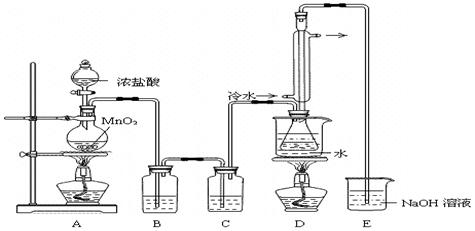
回答下列问题:
(1)装置B、C中玻璃容器的名称:;反应原理(填写数字序号):。
(2)实验中盐酸试剂通常采用36.5%的浓溶液,不用稀盐酸的理由是。
(3)D中冷凝管起到导气和冷凝双重作用,其冷却水流动方向与热气流流动方向相同(见图)。这种冷却方式可应用于下列高中化学中实验。
A.石油分馏 B.制取溴苯 C.制取乙酸乙酯 D.制备阿司匹林
(4)B装置中盛放的是,反应结束后从锥形瓶内混合物中分离出产品的方法是,D中采用热水浴加热的原因是。
(5)A部分仪器装配时,放好铁架台后,应先固定(填仪器名称),整套装置装配完毕后,应先进行再添加试剂。实验完毕,A中不再产生氯气时,可拆除装置。拆除时,最先的操作应当是。
(6)实验过程中,若缺少C装置,则发现产品浑浊不清,出现该现象的原因可用化学方程式表示为。实验完毕,当把剩余浓盐酸倒入E烧杯中与吸收了尾气的氢氧化钠溶液混合时,发现有少量黄绿色刺激性气体产生,产生该现象的原因是:(用离子方程式表示)。
明矾石的组成和明矾相似,此外还含有Al2O3和少量的Fe2O3等杂质,它是制取钾肥和冶炼铝的重 要原料,其步骤如下:
回答下列问题:
(1) 明矾石加人足量的稀氨水中浸出时发生反应的离子方程式为________________
(2) 沉淀物A中除含有Fe2O3外,还含有 ________、________。
(3) 操作①的名称为________、冷却结晶、过滤。
(4) 用14mol . L-1的浓氨水配制480 mL 2 mol . L‑1稀氨水:
①所用的容量瓶规格是________。
②稀释浓氨水用的烧杯和玻璃棒如何洗涤?________________________
③下列操作对所配制的稀氨水浓度的影响(填“偏大”、“偏小”或“无影响”
a.洗涤后的容量瓶中有少量蒸馏水:________。
b.浓氨水量取后,所用的量筒用蒸馏水洗涤2〜3次,并将洗涤液转人容量瓶中: 。
(5) 确定钾氮复合肥中含有钾元素的方法是。
(6) 为测定钾氮复合肥中氮元素的质量分数,称取mg钾氮复合肥,加人足量的NaOH浓溶液加热,使产生的气体全部逸出,收集到的氨气折箅成标准状况下的体积为V mL。则钾氮复合肥中氮元素的质量分数为________ (用含m、V的代数式表示)。