分类方法在化学学科的发展中起到非常重要的作用。下列分类标准合理的是
①根据酸分子中含有氢原子的个数,将酸分为一元酸、二元酸、三元酸等
②根据化合物在溶液中电离出离子的类别,将化合物分为酸、碱、盐
③根据金属能否与酸反应,将金属分为活泼金属和不活泼金属
④根据反应物和生成物的类别以及反应前后物质种类的多少,把化学反应分为化合反应、分解反应、置换反应和复分解反应。
| A.①③ | B.②④ | C.①②④ | D.②③④ |
有机物甲可氧化生成羧酸,也可还原生成醇。由甲生成的羧酸和醇在一定条件下,可以生成化合物乙,其分子式为C2H4O2。下列叙述中不正确的是( )
| A.甲分子中C的质量分数为40% |
| B.甲在常温常压下为无色液体 |
| C.乙比甲的沸点高 |
| D.乙和甲的最简式相同 |
在一定条件下,既可以发生氧化反应,又可以发生还原反应,还可以和羧酸发生酯化反应的是( )
| A.乙醇 | B.乙醛 | C.乙酸 | D.葡萄糖 |
乳糖是一种二糖,可以水解生成葡萄糖和半乳糖。半乳糖和葡萄糖互为同分异构体,则乳糖的分子式为( )
| A.C6H12O6 |
| B.C18H30O15 |
| C.C12H24O12 |
| D.C12O22O11 |
某期刊封面上有如下图所示的一个分子的球棍模型图。图中:“棍”代表单键或双键;
不同颜色的球代表不同元素的原子。该模型图可代表一种( )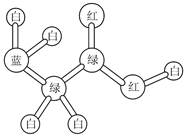
| A.卤代羧酸 | B.酯 | C.氨基酸 | D.醇钠 |
有A、B两种烃,含碳元素的质量分数相等,下列关于A和B的叙述正确的是( )
A.A和B一定是同分异构体
B.A和B不可能是同系物
C.A和B实验式一定相同
D.A和B各1 mol完全燃烧后生成的CO2的质量一定相等