(1)点燃不纯的氢气可能会发生爆炸,为了防止意外,可连接一个安全装置。下图的装置能起到此作用的是___________。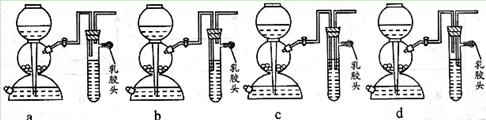
(2)取一定量的饱和氯水与CaCO3粉末混合,观察到少量气泡,氯水的黄绿色褪去,静止后取上层澄清溶液四份,分别进行以下实验:
① 一份滴加盐酸,产生大量气 泡
泡
② 一份滴加NaOH溶液,出现白色沉淀
③ 一份用酒精灯加热出现白色沉淀
④ 将有色布条浸入第四份溶液,布条立即褪色
由上述实验现象推测该澄清溶液的主要溶质是 ;
实验①可以用 方程式表示;
饱和氯水与CaCO3粉末发生反应的化学方程式 。
(9分)在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。下表是500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
| 成分 |
质量(g) |
摩尔质量(g ·mol-1) |
| 蔗糖 |
25.00 |
342 |
| 硫酸钾 |
0.25 |
174 |
| 阿司匹林 |
0.17 |
180 |
| 高锰酸钾 |
0.25 |
158 |
| 硝酸银 |
0.02 |
170 |
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是________。
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸银
(2)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为_______ mol/L。(注意:只要求用原始数据写表达式,不需要化简与计算)
(3)配制上述“鲜花保鲜剂”所需的仪器有:烧杯、电子天平、药匙、________________、______________、_______________。(在横线上填写所缺仪器的名称)
(4)在溶液配制过程中,下列操作对配制结果没有影响的是___________。
A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(12分)某同学用某种粗盐进行提纯实验,步骤见下图.请回答: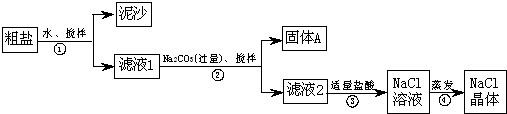
(1)步骤①和②的操作名称是________.
(2)步骤③判断加入盐酸“适量”的方法是__________________________________;步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止________________,当蒸发皿中有较多量固体出现时,应________________,用余热使水分蒸干.
(3)猜想和验证:
| 猜想 |
验证的方法 |
现象 |
结论 |
| 猜想Ⅰ:固体A中含 CaCO3、MgCO3 |
取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 |
____________ |
猜想Ⅰ成立 |
| 猜想Ⅱ:固体A中含 BaCO3 |
取少量固体A于试管中,先滴入________,再滴入Na2SO4溶液 |
有气泡放出,无白色沉淀 |
___________ |
| 猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 |
取少量NaCl晶体溶于试管中的蒸馏水,________ |
____________ |
猜想Ⅲ成立 |
( 10分)下列各组物质的分离或提纯,应选用下述方法的哪一种?(填序号)
| A.分液 | B.过滤 | C.萃取 | D.蒸馏 E、蒸发结晶 F、加热分解 |
(1)除去Ca(OH)2溶液中悬浮的 CaCO3;
(2)从碘水中提取碘;
(3)用自来水制取蒸馏水;
(4)分离植物油和水;
(5)除去 KCl 中少量 KClO3。
用Na2CO3·10H2O晶体,配制0.2 mol/L的Na2CO3溶液480 mL。
(1)实验中用到的玻璃仪器有量筒、玻璃棒、烧杯,还缺少_____________,_______ ____;
(2)应用托盘天平称取Na2CO3·10H2O的晶体的质量为_________________g;
(3)配制溶液时有以下几个操作:
①溶解 ②摇匀 ③洗涤 ④冷却 ⑤称量 ⑥转移溶液⑦定容
正确的操作顺序是__________________(填序号)。
(4)根据下列操作对所配溶液的浓度各有什么影响,完成填空。
①碳酸钠失去了部分结晶水 ②用“左码右物”的称量方法称量晶体
③碳酸钠晶体不纯,其中混有氯化钠④称量碳酸钠晶体时所用砝码生锈
⑤容量瓶未经干燥就使用
其中引起所配溶液浓度偏高的有____________,无影响的有________。(填序号)
海藻中含有丰富的碘元素(以I-形式存在)。实验室中提取碘的流程如下:
(图一)
(1)实验操作③的名称是,所用主要仪器名称为。
(2)提取碘的过程中,可供选择的有机试剂是(填序号)。
| A.酒精(沸点78℃) | B.四氯化碳(沸点77℃) |
| C.甘油(沸点290℃) | D.苯(沸点80℃) |
(3)为使从含碘有机溶液中提取碘并回收溶剂顺利进行,采用水浴加热蒸馏(如上图一所示)。请指出图中实验装置中错误之处(有几处填几处,下列空白可不填满,也可补充)
①,②,③,④,。
(4)实验中使用水浴的原因是,