恒温(1100℃)恒容密闭容器中发生反应:Na2SO4(s)+4H2(g)  Na2S(s)+4H2O(g)。下列说法正确的是
Na2S(s)+4H2O(g)。下列说法正确的是
| A.该反应的平衡常数表达式K=c(H2O)/c(H2) |
| B.若容器内气体的密度或压强保持不变,均说明该反应已达到平衡状态 |
| C.若Na2SO4足量,改变起始充入H2的浓度,达平衡时H2的转化率不变 |
| D.若初始时投入2.84gNa2SO4与一定量H2,反应达平衡时容器内固体共有2.264g,则Na2SO4的转化率为45% |
下列化学反应的热量变化可用:H+(aq) + OH-(aq) = H2O(l),△H= —57.2kJ/mol表示的是()
| A.含有1molH2SO4的浓硫酸与含有1molNaOH的稀溶液混合 |
| B.0.1 mol/L 的醋酸溶液与 1mol/L的NaOH溶液等体积混合 |
| C.1mol/L的盐酸10mL与1mol/L的NaOH15mL混合 |
| D.1mol/L的盐酸10mL与1mol/L的氨水15mL混合 |
一种“即食即热型快餐”适合外出旅行时使用。其内层是用铝箔包裹的、并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两种化学物质反应,此时便可对食物进行加热,这两包化学物质最合适的选择是()
| A.浓硫酸与水 | B.熟石灰与水 | C.生石灰与水 | D.氯化钠与水 |
已知氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,破坏1 mol氢气中的化学键消耗的能量为Q1KJ,破坏1 mol氯气中的化学键消耗的能量为Q2KJ,形成1 mol氯化氢中的化学键释放的能量为Q3KJ,则下列关系式中一定正确的是()
| A.Q1+Q2<2Q3 | B.Q1+Q2>2Q3 | C.Q1+Q2<Q3 | D.Q1+Q2=Q3 |
某反应的反应过程中能量变化如右图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是()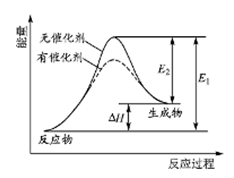
| A.该反应为放热反应 |
| B.催化剂能降低反应的活化能 |
| C.催化剂能改变反应的焓变 |
| D.逆反应的活化能大于正反应的活化能 |
从植物花中可提取一种简写为HIn的有机物,它在水溶液中因存在下列平衡:HIn(溶液,红色)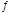 H+(溶液)+In-(溶液,黄色) 而用作酸碱指示剂。往该溶液中加入Na2O2粉末,则溶液颜色为()
H+(溶液)+In-(溶液,黄色) 而用作酸碱指示剂。往该溶液中加入Na2O2粉末,则溶液颜色为()
| A.黄色变浅 | B.红色变深 | C.褪为无色 | D.黄色变深 |