“毒鼠强”是一种灭鼠药,具有极强的毒性,国家已禁止使用。它是一种含有C、H、O、N、S的有机物,其摩尔质量为240 g/mol-1;其中所含碳元素的质量分数为20%,所含氢元素的质量分数为3.0%氧元素的质量分数为28%,其余为N、S。(写计算过程)
(1)误食0.1 g“毒鼠强”就可以使人死亡,0.1g“毒鼠强”的物质的量为多少?
(2)试求“毒鼠强”中C、H、O三种元素的原子个数比。
.(12分)由等物质的量的 和
和 组成的混合物18.400 g,与100 mL盐酸反应。(题中涉及的气体体积均为标准状况下,填空时可以用带字母的式子表示。)
组成的混合物18.400 g,与100 mL盐酸反应。(题中涉及的气体体积均为标准状况下,填空时可以用带字母的式子表示。)
(1)该混合物中 与
与 的质量分别为和。
的质量分别为和。
(2)若碳酸氢盐与盐酸恰好完全反应,则盐酸的物质的量浓度为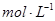 。
。
(3)如果盐酸过量,生成 的体积为L。
的体积为L。
(4)如果反应后碳酸氢盐有剩余,盐酸不足量,要计算生成 的体积,还需要知道。
的体积,还需要知道。
(5)若 和
和 不是以等物质的量混合,则18.4 g固体混合物与足量的盐酸完全反应时生成
不是以等物质的量混合,则18.4 g固体混合物与足量的盐酸完全反应时生成 的物质的量(用n表示)的范围是。
的物质的量(用n表示)的范围是。
向200 mL ,某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的pH>7。
(1)此时溶液的溶质如果是单一成分,可能是____________________;如果是多种成分,可能是__________________________。
(2)在上述所得溶液中,逐滴缓慢滴加2 mol·L-1的盐酸,所得气体(不考虑溶解于水)的体积与所加盐酸的体积关系如图所示:
①加入盐酸200 mL之前,无气体产生,写出OA段发生反应的离子方程式______________________________________________________。
②B点时,反应所得溶液中溶质的物质的量浓度是__________ (溶液体积的变化忽略不计)。
工业制硫酸的尾气中含较多的SO2,为防止污染空气,回收利用SO2,工业上常用氨水吸收法处理尾气。某校化学兴趣小组的同学为确定该方法所得固体的成分,称取该固体四份,溶于水后,分别逐滴加入相同浓度的硫酸溶液50 mL,产生SO2的体积(标准状况)如下表(实验时设法使水中溶解的SO2几乎完全逸出):
| 实验组别 |
① |
② |
③ |
④ |
| 硫酸溶液的体积(mL) |
50 |
50 |
50 |
50 |
| 盐的质量(g) |
9.260 |
13.890 |
20.835 |
32.410 |
| 二氧化硫的体积(mL) |
1344 |
2016 |
3024 |
2464 |
⑴上述四组实验中,SO2体积与固体的质量之比相同的组别有__________________;由第①组实验中的SO2体积与固体的质量之比,可以推算用6.945 g该固体进行同样的实验时,产生SO2_________mL(标准状况);根据表中两组数据变化可确认该固体中一定含有(NH4)2SO3。
⑵另取9.260 g该固体与足量的熟石灰共热,收集到标准状况的氨气的体积为3136 mL,则该固体的成分除(NH4)2SO3外还有___________(填化学式),该实验中使用的硫酸的物质的量浓度为_______________。
硝酸铜受热易分解:2Cu(NO3)2 2CuO+4NO2↑+O2↑,当温度达到800℃时,CuO开始分解:4CuO
2CuO+4NO2↑+O2↑,当温度达到800℃时,CuO开始分解:4CuO  2Cu2O+ O2↑,至1000℃以上,CuO完全分解(加热过程中忽略2NO2
2Cu2O+ O2↑,至1000℃以上,CuO完全分解(加热过程中忽略2NO2 N2O4,2NO2=2NO+O2等反应)。
N2O4,2NO2=2NO+O2等反应)。
现取5.64gCu(NO3)2无水晶体,在一定温度下使其分解,将生成的气体及时导出并用足量的NaOH溶液充分吸收。
⑴若该质量的无水硝酸铜经加热完全分解,其中的铜元素全部转化为氧化铜,则氧化铜的质量是__________g。
⑵若该质量的无水硝酸铜完全分解,铜元素全部转化为氧化亚铜,反应过程中生成的气体被足量的NaOH溶液充分吸收后,还有多余的气体,则多余的气体是________(填分子式),其体积(标准状况)是_____________L。
⑶若该质量的无水硝酸铜分解后的残留固体中含有1.60g CuO,则残留固体的质量可能
是_________g。
由CO2、H2O(g)组成的混合气体共a mol,其中CO2的物质的量分数为x。将该混合气体缓慢通过装有1mol Na2O2的真空管,充分反应后,维持120℃、1.01×105Pa。收集所得气体,冷却、称量,真空管中固体质量增加y g。
(1)若a=1,则y=____________(用含x代数式表示);
(2)若a=2,x=0.5时,反应后所得气体的成份是_____________;
(3)若a=2,y=28时,则x的取值范围____________________;
(4)若a=1.25,试在图中作出y与x的关系曲线,并在y轴标明曲线起点和终点的数值。