在H2O2分解实验中,当加入少量MnO2粉末时,H2O2的分解速率增大。该实验中使H2O2分解速率增大的主要因素是
| A.温度 | B.催化剂 | C.反应物的接触面积 | D.反应物的浓度 |
如图所示装置Ⅰ是一种可充电池,装置Ⅱ为电解池,离子交换膜只允许Na+通过,充放电的化学方程式为Na2S4+3NaBr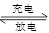 2Na2S2+NaBr3.闭合开关K时,b极附近先变红色.下列说法正确的是()
2Na2S2+NaBr3.闭合开关K时,b极附近先变红色.下列说法正确的是()
| A.负极反应为4Na-4e-═4Na+ |
| B.闭合K后,b电极附近的pH变小 |
| C.当有0.01mol Na+通过离子交换膜时,b电极上析出标准状况下的气体112mL |
| D.闭合K后,a电极上产生的气体具有漂白性 |
甲、乙、丙、丁4种化合物均含有2种或3种元素,分子中均含有18个电子。甲是气态氢化物。在水中分步电离出两种阴离子。下列推断合理的是()
| A.某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应 |
| B.乙和甲中同种元素的质量分数相等,则乙中含有化合价为-1的元素 |
| C.丙与氧气的摩尔质量相同,则丙一定仅由两种元素组成 |
| D.丁中含有第二周期ⅣA族元素,则丁一定是甲烷的同系物 |
将一定体积的CO2通入VLNaOH溶液中,恰好完全反应,若在反应后的溶液中加入足量大理石水,得到ag沉淀,若在反应后的溶液中加入足量CaCl2溶液,得到bg沉淀,则下列说法正确的是()
| A.不能确定a、b的大小关系 |
| B.若a=b,则CO2与NaOH溶液反应生成的盐只有Na2CO3 |
| C.用上述数据不能确定NaOH溶液的物质的量浓度 |
| D.参加反应的CO2体积为0.224bL |
如下图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+3B(g) 2C(g)△H=-192kJ•mol-1.向M、N中,分别通入xmolA和ymolB的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是()
2C(g)△H=-192kJ•mol-1.向M、N中,分别通入xmolA和ymolB的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是()
| A.若平衡时A气体在两容器中的体积分数相等,则x一定等于y |
| B.若x:y=1:2,则平衡时,M中的转化率:A>B |
| C.若x:y=1:3,当M中放出热量172.8 kJ时,A的转化率为90% |
| D.若x=1.5,y=4.5,M中达到平衡时体积为1L,含C气体1mol,此时再通入1molA和1molC时,v(正)>v(逆) |
O3也是一种很好的消毒剂,具有高效、洁净、方便、经济等优点。O3可溶于水,在水中易分解,产生的[O]为游离氧原子,有很强的杀毒消毒能力。常温常压下发生反应如下:反应①O3⇌O2+[O]△H>0 平衡常数为K1;
反应②[O]+O3=2O2△H<0 平衡常数为K2;
总反应:2O3=3O2△H<0 平衡常数为K
下列叙述正确的是()
| A.升高温度,K增大 |
| B.K=K1+K2 |
| C.压强增大,K2减小 |
| D.适当升温,可提高消毒效率 |