在一个密闭的容器中发生如下反应,2SO2(g)+O2(g) 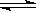 2SO3(g),反应过程中某一时刻SO2、O2、SO3的浓度均为0.2 mol·L-1,当达到平衡时可能的数据是( )
2SO3(g),反应过程中某一时刻SO2、O2、SO3的浓度均为0.2 mol·L-1,当达到平衡时可能的数据是( )
| A.c(SO3)="0.4" mol·L-1 | B.c(SO3)= c(SO2)="0.15" mol·L-1 |
| C.c(SO2)="0.25" mol·L-1 | D.c(O2)="0.3" mol·L-1 |
欲将氯化钠、沙子(主要成分为SiO2)、碘三种物质组成的固体混合物分离,最科学的操作顺序是()
| A.溶解、过滤、加热(升华)、蒸发(结晶) |
| B.加热(升华)、溶解、过滤、蒸发(结晶) |
| C.升华、溶解、蒸馏、结晶 |
| D.溶解、结晶、过滤、升华 |
下列液体分别与溴水混合,振荡静置后上层液体呈橙色,下层液体呈无色的是()
| A.四氯化碳 | B.苯 | C.氯水 | D.溴化钾溶液 |
下列反应在通常情况下可以发生:①2FeCl3+Cu====2FeCl2+CuCl2
②Fe+CuSO4====FeSO4+Cu③2FeCl3+2KI====2FeCl2+2KCl+I2
④6FeCl2+3Br2====4FeCl3+2FeBr3,则下列氧化性强弱顺序正确的是( )
| A.Br2>Fe3+>I2 | B.Fe3+>Br2>I2 | C.Br2>I2>Fe3+ | D.Fe2+>Cu2+>Fe3+ |
正好能还原1 mol H+的是( )
| A.17 g OH- | B.23 g Na | C.71 g Cl2 | D.9 g Al |
下列离子方程式正确的是( )
A.小苏打与烧碱反应: +OH-====CO2↑+H2O+O2- +OH-====CO2↑+H2O+O2- |
| B.金属钠和水反应:2Na+2H2O====2Na++2OH-+H2↑ |
C.苏打与稀硫酸反应: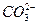 +2H+====CO2↑+H2O +2H+====CO2↑+H2O |
| D.Fe与硫酸铜溶液反应:2Fe+3Cu2+====2Fe3++3Cu |