(24分,每空3分)
(1)将4molSO2和2molO2充入2L的密闭容器中,在一定条件下发生反应,经10s后达到平衡,测得SO3 的浓度为0.6mol·L-1,请回答下列问题:
的浓度为0.6mol·L-1,请回答下列问题:
①用O2表示的反应的平均速率为___________________________ __________
__________
②平衡时SO2的转化率______________________________________
③平衡时SO3的体积分数为___________________________
④10s时O2的浓度为_____________________________________________
(2)已知某可逆反应mA(g)+nB(g)  qC(g)在密闭容器中进行。
qC(g)在密闭容器中进行。
如图所示反应在不同时间t,温度T和压强P与反应物B的体积
分数的关系曲线。根据图象填空
①化学计量数的关系:m+n______q;(填“ >”.“<”或“=”)
>”.“<”或“=”)
②该反应的正反应为___________反应。(填“吸热”或“放热”)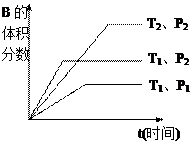
(3)在FeCl3+3KSCN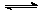 Fe(SCN)3+3KCl的平衡体系中,回答下列问题:
Fe(SCN)3+3KCl的平衡体系中,回答下列问题:
(填“正向”、“逆向”、“不”)
①在溶液中加入少量的KSCN固体,平衡 ______________移动。
②在溶液中加入少量的KCl固体, 平衡 _____________移动。
平衡 _____________移动。
实验室制备溴乙烷(C2H5Br)的装置和步骤如右图:(已知溴乙烷的沸点38.4℃)
①检查装置的气密性,向装置图所示的U型管和大烧杯中加入冰水;
②在圆底烧瓶中加入10mL95%乙醇、28mL浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;
③小心加热,使其充分反应。
回答下列问题: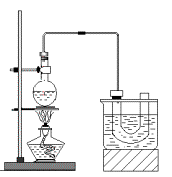
(1)该实验制取溴乙烷的化学方程式为(生成的盐为NaHSO4):___________________________。
(2)反应时若温度过高,可看到有红棕色气体产生,其成分为__________(写分子式)。
(3)为了更好的控制反应温度,除用图示的小火加热,更好的加热方式是__________。
(4)U型管内可观察到的现象是_____________________________。
(5)反应结束后,U形管中粗制的C2H5Br呈棕黄色。为了除去粗产品中的杂质,可选择下列试剂中的_________________(填序号)
| A.苯 | B.H2O | C.Na2SO3溶液 | D.CCl4 |
所需的主要玻璃仪器是______________(填仪器名称)。
(6)下列几项实验步骤,可用于检验溴乙烷中溴元素,其正确的操作顺序是:取少量溴乙烷,然后__________________(填代号)。
①加热;②加入AgNO3溶液;③加入稀HNO3酸化;④加入NaOH溶液;⑤冷却
现有物质B-I的转化关系如下图:
若B的分子式为C8H8O,其苯环上的一元取代物只有两种;G为高分子化合物。请回答下列问题:
(1)反应②的反应类型是。
(2)写出有关物质的结构简式:F,I。
(3)写出下列反应的化学方程式:
B与新制Cu(OH)2悬浊液的反应;
C+D→H。
(4)C的同分异构体且属于酯类的芳香族化合物共有6种,以下已有三种,请写出另三种同分异构体的结构简式: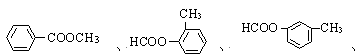
、;
从某些植物树叶提取的挥发油中含有下列主要成分:
(1)写出A的分子式,C的含氧官能团名称为。
(2)1molB与溴水充分反应,需消耗mol单质溴。
(3)写出C在一定条件下与足量H2反应的化学方程式:。
(4)已知: 写出C在强氧化剂条件下生成的有机化合物的结构简式。
写出C在强氧化剂条件下生成的有机化合物的结构简式。
(5)写出A和B在一定条件下反应,生成高分子化合物的化学方程式:
。
按要求写出下列反应的化学方程式:
(1)在苯酚钠中通入少量的CO2:
(2)HCHO与足量的银氨溶液反应:
(3)CH3CH(OH)CH2OH与氧气的催化氧化:
(4)HOOC-COOH与乙二醇反应生成环酯:
将一定量的CO2气体通入500mL某NaOH溶液中,充分反应后,将溶液在低温进行蒸发,得到不含结晶水的白色固体A。取三份质量不同的A样品分别与50mL相同浓度的盐酸反应,得到气体的体积(标准状况)与固体A的质量关系如下表所示:
| 组别 |
1 |
2 |
3 |
| 盐酸体积(mL) |
50 |
50 |
50 |
| A的质量(g) |
3.80 |
5.70 |
7.60 |
| 气体体积(mL) |
896 |
1344 |
1344 |
(1)上表中第组数据加入的50mL盐酸的反应后有剩余,
(2)试推断:A的成份为
(3)盐酸的物质的量的浓度为mol·L-1