(12分)甲、乙、丙、丁四种物质均为下列离子组成的可溶性化合物,组成这四种物质的离子(离子不能重复组合)有:
| 阳离子 |
Ag+、Mg2+、Al3+、Ba2+ |
| 阴离子 |
Cl-、SO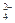 、NO3-、OH- 、NO3-、OH- |
现进行以下实验,
①将乙的溶液分别加到足量甲、丁两溶液中时均产生稳定的白色沉淀; ②将少量丙溶液滴入丁溶液时产生白色沉淀,当丙过量时沉淀完全溶解;
②将少量丙溶液滴入丁溶液时产生白色沉淀,当丙过量时沉淀完全溶解;
③甲、丙两溶液混合时产生的白色沉淀,经分析其中含有两种成份。
据此回答下列问题:
(1)写出下列物质的化学式:甲 乙
(2)丙的阴离子的电子式是 ,丁的阳离子的结构示意图是 ;
(3)写出相应离子方程式:
①甲溶液与丙溶液混合: 
②乙溶液与丁溶液混合:
为了探究植物吸水和吸收矿质离子的特点和关系,用相同的培养液,分别培养水稻和番茄幼苗。培养一段时间后,分别测定培养液中各种养分的百分含量,并与原培养液(各种养分的相对百分含量100%)中各种养分的百分含量比较,结果如图所示。请据图回答相关问题:
(1)水稻的培养液中,Mg2+的相对浓度比原来升高了,这是由于水稻___________________
________________________________________________________________________。
(2)番茄的培养液中,Mg2+和Si4+的浓度变化不同,说明
________________________________________________________________________。
(3)培养水稻和番茄的培养液中,Si4+的浓度变化不同,说明________________________________________________________________________。
(4)为使上述结果反映水稻和番茄吸水和吸收矿质营养的特点,除把实验装置放在同一环境中外,还应将培养容器密封好,防止_______________________________________________;
注意调节培养液的酸碱度,并经常(每天2~3次)向培养液中通入________,保证根细胞________________________________________________________________________。
已知某酸性土壤浸取液中除含Fe3+外,还含有一定量Mg2+和Al3+。请设计合理实验检验该浸取液中的Fe3+、Mg2+、Al3+。
限选实验用品与试剂:烧杯、试管、玻璃棒、滴管、玻璃片、pH试纸;浸取液、20%KSCN、0.1 mol·L-1NaOH溶液、6 mol·L-1NaOH溶液、0.1 mol·L-1盐酸、蒸馏水。
必要时可参考:
| 沉淀物 |
开始沉 淀时的pH |
沉淀完全 时的pH |
| Mg(OH)2 |
9.6 |
11.1 |
| Fe(OH)3 |
2.7 |
3.7 |
根据你设计的实验方案,叙述实验操作、预期现象和结论。(测定溶液pH的具体操作可不写)
| 实验操作 |
预期现象和结论 |
| 步骤1: |
|
| 步骤2: |
|
| 步骤3: |
|
| …… |
含MgCl2、KCl、Na2SO4三种物质的混合溶液。已知其中含Cl- 0.5 mol,K+和Na+共0.5 mol,Mg2+ 0.5 mol,则 的物质的量为________。
的物质的量为________。
有体积相同的某植物营养液两份,其配方如下:
(1)0.3 mol KCl、0.2 mol K2SO4和0.1 mol ZnSO4;
(2)0.1 mol KCl、0.3 mol K2SO4和一定物质的量的ZnCl2。
若使两份营养液中各离子的物质的量均相等,则第(2)份营养液中ZnCl2的物质的量为________。
当前,大量施用氮素化肥是冬小麦获得高产的重要措施之一。
(1)施入土壤的氮素化肥主要以__________________形式被小麦根部吸收,透气性较好的土壤,植物容易吸收氮素化肥,透气性较差的黏质土壤,则根的吸肥力差,这是因为________________________________________________________________________
________________________________________________________________________。
(2)施肥后要及时灌溉,若从麦田流失的水从下图A位置注入一条河流,导致下游水体中藻类和细菌数量发生的变化如下列曲线图所示:
①在A的下游藻类数量增加的原因是______________________________________
________________________________________________________________________。
②在3 km以外的河段,细菌数量迅速增加的原因是
________________________________________________________________________。
③在下游6 km处的河段发现鱼类大量死亡,原因是
________________________________________________________________________。
④在距A 2 km处,水中的氧气含量比A处高,原因是
________________________________________________________________________。
请你参与识别化肥的探究活动,有五种化肥,分别是硫酸钾、氯化钾、碳酸氢铵、氯化铵和硝酸铵。
(1)第一步:称取五种化肥各10 g,分别研细;
(2)第二步:硝酸铵和熟石灰反应的化学方程式是: _______________________________
________________________________________________________________________;
(3)第三步:另取三种铵盐各少量,分盛于三支试管中,均滴入少量盐酸,无明显现象的是________________________________________________________________________,
有气泡放出的是________,反应的化学方程式____________________________________
________________________________________________________________________;
(4)第四步:另取氯化铵和硝酸铵两种铵盐进行识别,写出识别时发生反应的化学方程式:________________________________________________________________________
________________________________________________________________________;
(5)第五步:取两种钾盐,分别在试管中配成溶液,各滴入几滴氯化钡溶液,生成白色沉淀的钾盐是________,无明显现象的钾盐是________。