足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与3.36 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol·L-1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
| A.60 mL | B.90 mL | C.120 mL | D.45 mL |
下列叙述中正确的是
A.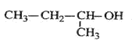 的命名为:2-甲基-1-丙醇 的命名为:2-甲基-1-丙醇 |
| B.软脂酸和油酸互为同系物 |
| C.聚乙烯能使溴水褪色 |
D. 分子中至少有11个碳原子处于同一平面 分子中至少有11个碳原子处于同一平面 |
某化学研究性学习小组对溶液作如下的归纳总结(均在常温下)。其中正确的是
①pH=3的强酸溶液1 mL,加水稀释至100 mL后,溶液pH降低2个单位
②1 L 0.50 mol·L-1 NH4Cl 溶液与2 L 0.25 mol·L-1 NH4Cl 溶液含NH4+物质的量前者大
③在某钠盐溶液中含有等物质的量的Cl-、I-、AlO2-、CO32-、NO3-、SiO32-中若干种,当加入过量的盐酸产生气泡,溶液颜色变深,则原溶液中一定有CO32-
④pH=4、浓度均为0.1 mol·L-1 的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)+c(CH3COOH)=2c(Na +) mol/L
| A.①② | B.②③ | C.①③ | D.②④ |
下列离子方程式正确的是
A.NaHS溶液水解的方程式为:HS-+H2O S2-+H3O+ S2-+H3O+ |
| B.向H218O中投入Na2O2固体: 2H218O + 2Na2O2 ===4Na++ 4OH-+ 18O2↑ |
| C.在100 mL 2 mol/L FeBr2溶液中通入4.48 L氯气(标况下),充分反应:2Fe2+ + 2Br-+ 2Cl2="==" 2Fe3++Br2+4Cl- |
D.用惰性电极电解饱和氯化钠溶液:2Cl-+2H+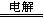 H2↑+Cl2↑ H2↑+Cl2↑ |
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2 +O2→2CH3CHO。
下列有关说法正确的是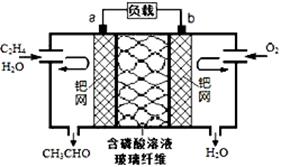
| A.电子移动方向:电极a→磷酸溶液→电极b |
| B.正极反应式为:CH2=CH2-2e- + 2OH- = CH3CHO + H2O |
| C.每有0.1mol O2反应,则迁移H+ 0.4mol |
| D.该电池为可充电电池 |