A、B、C、D、E、F为短周期六种元素,原子序数依次增大,其中A与E同主族且能形成离子化合物EA,B与F同主族,E与F同周期。D的核电荷数是B的最外层电子数2倍,单质F是一种重要的半导体材料。则下列推断中不正确的是
A.由A、C、D三种元素组成的化合物可以是离子化合物
B.F与D形成的化合物熔点高,可以与某种酸反应
C.原子半径由大到小的顺序是:E>F>C>D
D.五种元素中最高价氧化物对应的水化物酸性最强的是D[
下列离子方程式属于盐的水解,且书写正确的是
A.NaHCO3溶液:HCO3-+H2O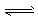 CO32-+H3O+ CO32-+H3O+ |
B.NaHS溶液:HS-+H2O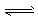 H2S+OH- H2S+OH- |
C.Na2CO3溶液:CO32-+2H2O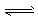 H2CO3+2OH- H2CO3+2OH- |
D.NH4Cl溶于D2O中:NH4++D2O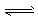 NH3·D2O+H+ NH3·D2O+H+ |
25°C时,水的电离达到平衡:H2O H++OH-,下列叙述正确的是
H++OH-,下列叙述正确的是
| A.将纯水加热到95°C时,Kw变大,pH不变,水仍呈中性 |
| B.向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,Kw变小 |
| C.向纯水中加人少量碳酸钠固体,c(H+)减小,Kw不变,影响水的电离平衡 |
| D.向纯水中加入醋酸钠或盐酸,均可抑制水的电离,Kw不变 |
根据如图所示的反应判断下列说法中错误的是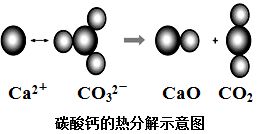
| A.CO2(g)和CaO(s)的总能量大于CaCO3(s)的总能量 |
| B.该反应的焓变大于零 |
| C.该反应中有离子键断裂也有共价键断裂,化学键断裂吸收能量,化学键生成放出能量 |
| D.由该反应可推出凡是需要加热才发生的反应均为吸热反应 |
下表中物质的分类组合正确的是
| A |
B |
C |
D |
|
| 强电解质 |
Al2(SO4)3 |
BaSO4 |
HF |
KClO3 |
| 弱电解质 |
H3PO4 |
H2O |
CaCO3 |
Al(OH)3 |
| 非电解质 |
CO2 |
NH3·H2O |
NH3 |
HI |
在水溶液中,因发生水解反应而不能大量共存的一组离子是
| A.CO32-、OH-、Na+、H+ | B.Al3+、Na+、AlO2-、Cl- |
| C.Ba2+、HCO3-、K+、SO42- | D.S2-、H+、SO42- 、Cu2+ |